이에이치엘바이오·SK플라즈마·시네오스헬스코리아, 3상 승인

|
국내 임상시험 지형이 전면적으로 재편되고 있다. 전통적 항암제 중심 구조를 넘어, 세포·유전자치료제, ADC, 항체 기반 면역조절제, 줄기세포 치료제, 내성극복 항암제 파이프라인까지 모든 영역에서 신약개발이 동시다발적으로 확대되고 있다. 기업 전략 역시 단일 모달리티를 벗어나 다계열·다플랫폼 체제로 이동하는 흐름이 뚜렸해지고 있다.
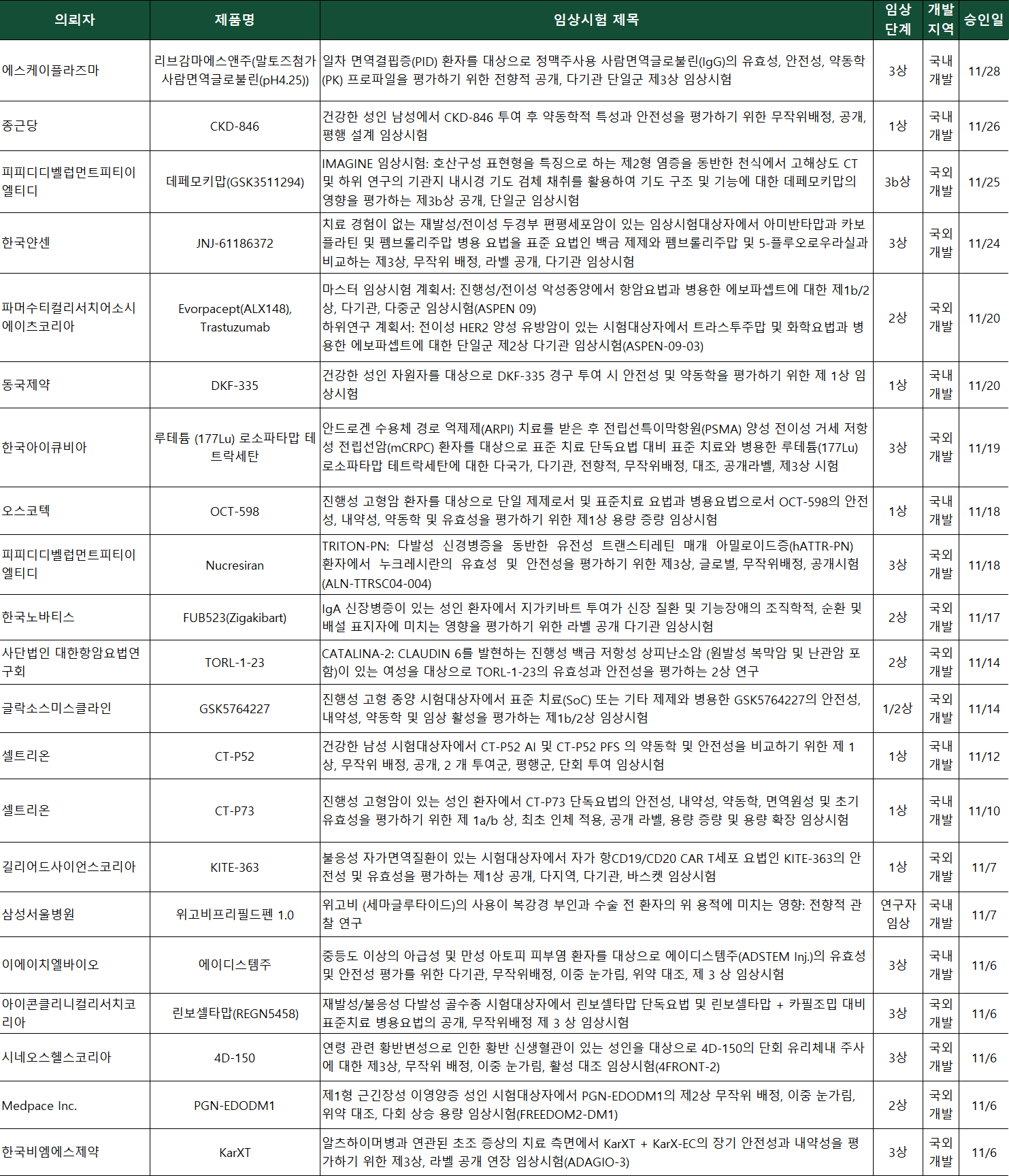
약업신문이 11일 식품의약품안전처 의약품통합정보시스템과 한국바이오의약품협회의 IND(임상시험계획서) 승인 자료를 종합 분석했다. 그 결과, 11월 한 달 동안 셀트리온·종근당·동국제약·오스코텍·이에이치엘바이오·시네오스헬스코리아(4D 몰레큘러 테라퓨틱스)·SK플라즈마 등이 계열 내 최초(first-in-class) 신약과 새로운 모달리티(Modality) 기반 후보물질 등, 주목할 만한 신규 임상시험 승인을 획득한 것으로 나타났다.
셀트리온이 기존 면역·자가면역 중심 바이오시밀러에서 항암 ADC 분야까지 개발 영역을 넓히며 파이프라인 다각화 속도를 높이고 있다.
셀트리온은 인터루킨-17A(IL-17A)를 표적하는 익세키주맙(오리지널 탈츠)의 바이오시밀러 ‘CT-P52’ 임상 1상을 승인받았다. 탈츠는 건선, 건선성 관절염, 강직성 척추염 등 다양한 자가면역질환에 사용되는 대표적 블록버스터다. 최근 글로벌 연매출은 30억 달러(약 4조원) 수준으로 형성돼 있다.
이번 1상은 건강한 성인 남성을 대상으로 오리지널과 CT-P52 자동주사기(AI) 제형과 프리필드시린지(PFS) 제형 간 약동학(PK)과 안전성을 비교할 예정이다. 셀트리온은 두 제형의 PK 특성과 사용성 차이를 검토해 향후 제형 개발 전략의 근거를 확보한다는 계획이다.
셀트리온은 여기에 더해 조직인자(Tissue Factor, TF)를 표적하는 항체-약물접합체(ADC) ‘CT-P73’의 1a/1b상도 승인받았다. 이번 시험은 최초 인체 적용으로, 진행성 고형암 환자를 대상으로 안전성, 내약성, 약동학, 면역원성뿐 아니라 초기 항종양 활성까지 폭넓게 평가하도록 설계됐다.
TF는 췌장암, 폐암, 난소암 등 다양한 고형암에서 과발현되는 표적으로 알려졌다. ADC 형태로 개발할 때 선택적 약물 전달 효과를 기대할 수 있다. 셀트리온은 CT-P73과 함께 ‘CT-P70’ ‘CT-P71’로 이어지는 ADC 시리즈를 구축했다.
종근당이 양성 전립선비대증(BPH) 치료제 ‘CKD-846’ 임상 1상에 돌입하며 신약 파이프라인을 한층 강화하고 있다. CKD-846은 BPH를 적응증으로 한 종근당의 자체 개발 후보물질이다. 구체적인 정보는 공개되지 않았지만, 개량신약으로서 약동학·투여 편의성 개선 가능성을 검증하는 단계에 들어섰다는 점에서 종근당의 연구개발 역량을 확인할 수 있는 대목이다.
종근당은 이미 두타스테리드 제제 ‘두테스몰’, 타다라필 제제 ‘센돔’ 등 비뇨생식기관 포트폴리오를 보유하고 있다. 여기에 CKD-846을 신규 파이프라인으로 추가해 고령화로 증가하는 관련 치료 수요에 대응한다는 전략이다. 특히 최근 수년간 혁신신약과 개량신약을 병행하는 R&D 투자를 확대해 온 만큼, CKD-846은 종근당의 연구개발 역량을 또 한 번 입증하는 사례로 평가된다.
동국제약이 액제 기반 골다공증 치료제 개발을 다시 확대하고 있다. 동국제약은 골다공증 치료제 ‘DKF-335’ 임상 1상을 승인받았다. 이번 시험은 건강한 성인을 대상으로 경구 투여 시 안전성과 약동학 특성을 평가하는 초기 단계 연구다. DKF-335는 비스포스포네이트(Bisphosphonate) 성분 리세드론산(Risedronate)과 비타민 D3 콜레칼시페롤(Cholecalciferol)을 결합한 복합 액제다.
동국제약이 2014년 첫 액제 골다공증 치료제 ‘마시본액’, 이후 복용량을 크게 줄인 ‘마시본에스액’을 출시하며 복용 편의성을 개선해 왔다. 이번 복합 액제 개발도 복용 요건이 까다로운 비스포스포네이트 계열의 낮은 순응도를 개선하기 위한 새로운 옵션을 확보하려는 시도로 평가된다.
오스코텍이 차세대 항내성 항암 후보물질 ‘OCT-598’ 임상 1상에 착수했다. OCT-598은 프로스타글란딘 E₂(PGE2) 신호를 매개하는 EP2·EP4 수용체를 동시에 차단하는 이중 저해제다. 종양 미세환경에서 나타나는 항암제 내성과 면역 회피 억제를 목표로 개발 중이다. PGE2-EP2/EP4 신호는 항암제 투여 후 종양 조직에서 면역억제성과 재발을 촉진하는 요인으로 알려졌다.
회사에 따르면, 전임상 연구에서 EP2·EP4를 동시에 차단할 경우 종양 성장 억제와 항종양 면역반응 강화 효과가 나타났다. 이번 1상은 진행성 고형암 환자를 대상으로 단독 투여군과 표준 항암요법 병용 투여군을 포함한 용량 증량 설계로 진행된다. 오스코텍은 OCT-598을 글로벌 내성 극복형 항암제로 개발하기 위해 미국 임상 확장도 검토 중이다.
이 밖에도 임상 3상 승인 소식도 잇따랐다. 이에이치엘바이오는 중등도 이상 만성 아토피 피부염 환자를 대상으로 한 자가 지방유래 줄기세포 치료제 ‘에이디스템주’ 임상 3상 승인을 획득했다. 에이디스템주는 병변 주변 환경 개선(Paracrine effect) 효과를 통한 면역 균형을 조절하는 메커니즘을 지녔다.
시네오스헬스코리아는 미국 4D 몰레큘러 테라퓨틱스(4D Molecular Therapeutics)의 AAV(아데노부속바이러스) 기반 유전자치료제 ‘4D-150’의 3상을 승인받았다. 4D-150은 습성 황반변성을 대상으로 VEGF 신호를 이중으로 차단하도록 설계된 치료제다. AAV R100 벡터에 아플리버셉트(Aflibercept)와 VEGF-C 표적 RNAi를 동시에 탑재한 이중 트랜스진(Dual-transgene) 유전자치료제다. 1회 주사만으로도 장기간 항-VEGF 효과 유지를 목표로 개발됐다는 점이 핵심이다. 지난달에는 일본 오츠카제약이 4D-150의 아시아와 오세아니아 지역 독점 개발 및 판권을 취득했다.
SK플라즈마는 일차 면역결핍증 환자를 대상으로 ‘리브감마에스앤주’의 유효성과 안전성을 검증하는 임상 3상에 진입했다.
|
-
01 11월 임상 키워드 ‘포트폴리오 재편’…셀트리... -
02 서울시약 "약사(藥事) 용어, 회원의 집단지... -
03 "CDMO 특별법, '반쪽짜리' 안 되려면 R&D·품... -
04 '제약바이오산업 제조혁신'...스마트팩토리 ... -
05 투키사, HER2 양성 유지요법 3상서 PFS 35.9... -
06 로슈 기레데스트란트 유방암 재발ㆍ사망률 3... -
07 젤네일 ‘매직 리무버’ 독성 물질 검출 우려 -
08 미국 남성 뷰티 공략 K-뷰티, 전신용·다기능... -
09 화장품 기업 80개사 3Q 누적 해외매출 및 ... -
10 "제약바이오 글로벌 도약, 해법은 제조혁신"...











