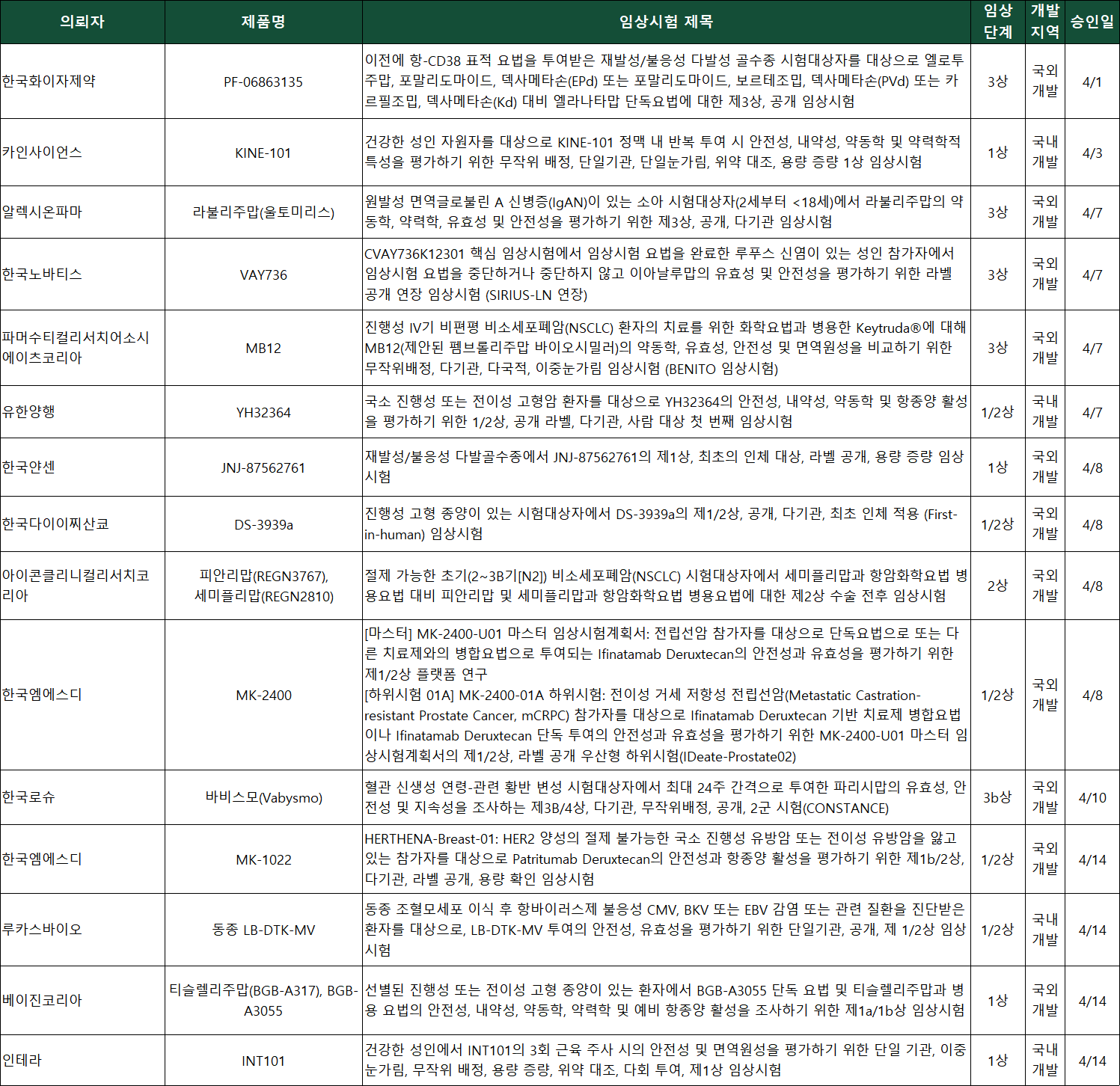
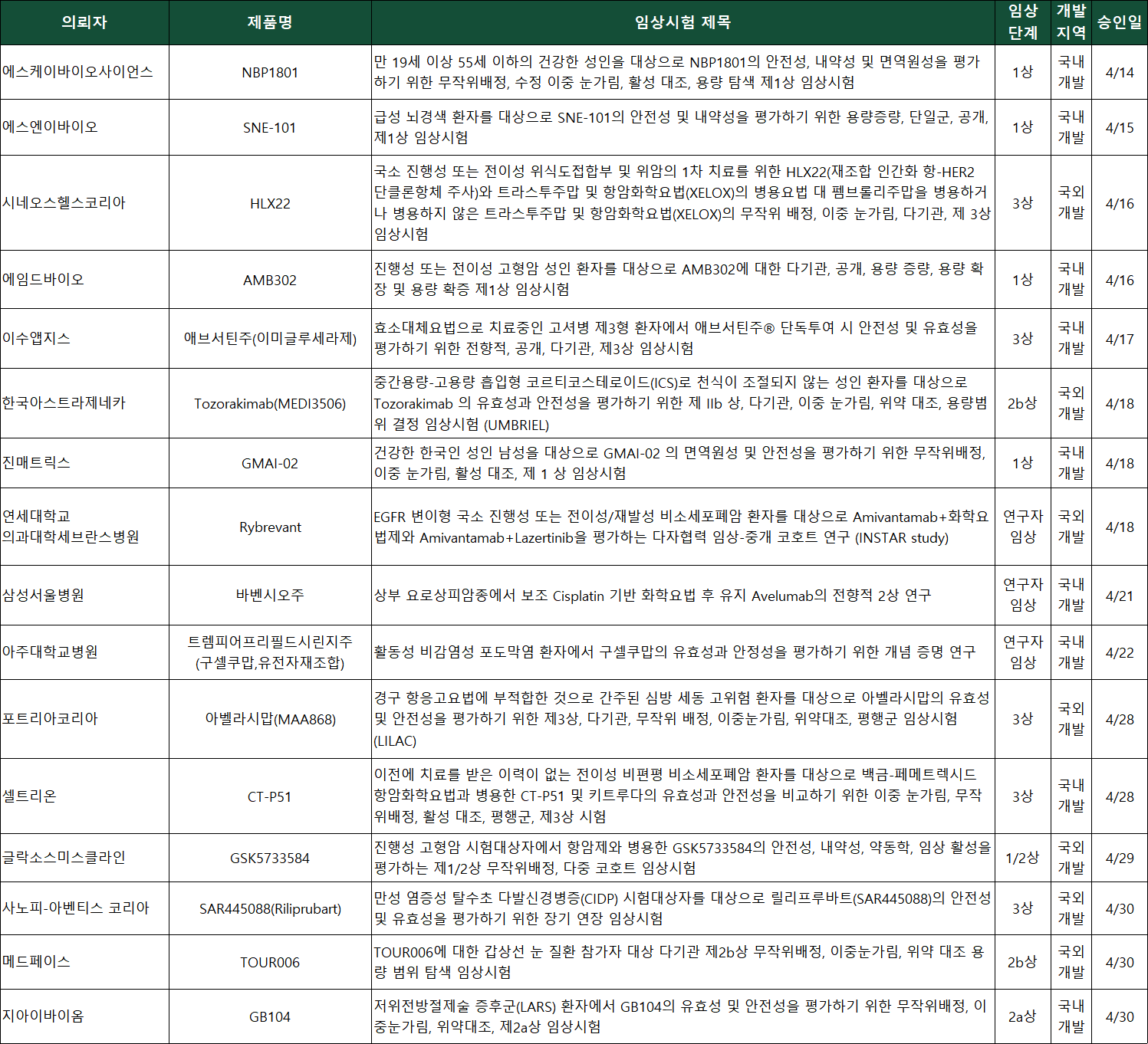
승인 IND 총 31건 중 1상 14건, 2상 4건, 연구자 주도 임상 3건 승인

|
지난 4월 한 달간 국내에서 개발된 바이오의약품만 13건이 임상시험계획(Investigational New Drug, IND) 승인을 받으며, 침체됐던 신약개발 산업에 다시 활력이 돌고 있다. 국내 개발 항암제, 희귀질환, 백신, 엑소좀, 면역세포, 마이크로바이옴 등 다양한 타깃과 모달리티가 임상 단계로 빠르게 진입하고 있다.
약업신문이 22일 식품의약품안전처 의약품통합정보시스템과 한국바이오의약품협회 자료를 분석한 결과, 4월 한 달간 총 31건의 바이오의약품 IND가 승인된 것으로 확인됐다. 2월(33건), 3월(32건)에 이어 3개월 연속 30건 이상 승인을 기록했다.
특히 국내 개발 바이오의약품 IND가 총 13건(약 42%) 승인되며, 국내 바이오신약 산업이 임상 중심 연구개발 단계로 진입하는 것을 보여줬다. 4월 IND를 승인받은 국내 개발 기업과 기관은 △지아이바이옴 △셀트리온 △아주대학교병원 △삼성서울병원 △진매트릭스 △이수앱지스 △에임드바이오 △에스엔이바이오 △루카스바이오 △인테라 △SK바이오사이언스 △유한양행 △카인사이언스다.
임상시험 단계별로는 1상(1/2상) 임상이 14건으로 가장 많았고, 3상은 10건, 2상(2/3상)은 4건, 연구자 주도 임상은 3건이었다.
3상 임상시험 승인 기업과 기업은 △사노피아벤티스코리아 △포트리아코리아(CRO) △셀트리온 △이수앱지스 △시네오스헬스코리아(CRO) △한국로슈 △알렉시온파마 △한국노바티스 △파머수티컬리서치어소시에이츠코리아(CRO) △한국화이자제약이다.
유한양행은 고형암 환자를 대상으로 이중 특이성 항체 기반 면역항암제 'YH32364' 임상 1/2상을 승인받았다. YH32364는 에이비엘바이오와 공동 개발한 면역항암제로, EGFR을 차단하고 4-1BB를 자극해 T세포 활성을 유도한다. 기존 EGFR 타깃 단일항체가 일부 암종에 국한되는 한계를 극복하고, 보다 넓은 적응증 확장을 목표로 한다.
SK바이오사이언스는 A형 간염 백신 후보물질 'NBP1801' 임상 1상을 승인받았다. 현재 국내에서 사용되는 A형 간염 백신은 대부분 수입에 의존하고 있다. 위생 환경이 개선된 국가에서는 성인 감염 시 중증으로 진행될 가능성이 크다. SK바이오사이언스는 NBP1801을 통해 국산 백신 자급화와 더불어 글로벌 수출까지 겨냥하고 있다.
진매트릭스도 A형 간염 백신 후보물질 'GMAI-02' 임상 1상을 승인받았다. 이번 임상에서는 GSK의 '하브릭스주'와의 면역원성 및 안전성 비교가 진행된다. GMAI-02는 비임상 효력시험에서 기존 백신 대비 약 1.6배 높은 항체가와 동등 이상의 방어 효력이 확인됐다. 두 회사의 A형 간염 백신 후보물질은 바이러스 균주부터 백신 완제품까지 전 공정을 독자 기술로 개발한 완전 국산 백신이다.
셀트리온이 글로벌 블록버스터 면역항암제 '키트루다' 바이오시밀러 개발 마무리 단계에 접어들며, 사실상 확보가 목전에 다다랐다. 셀트리온은 전이성 비편평 비소세포폐암(NSCLC) 환자를 대상으로 'CT-P51' 글로벌 임상 3상을 승인받았다. 이번 임상은 CT-P51와 키트루다를 직접 비교를 통해 유효성과 안전성을 평가한다.
이수앱지스는 고셔병 제3형 환자를 대상으로 효소대체요법(ERT) 치료제 '애브서틴주'의 단독 투여 임상 3상을 승인받았다. 현재 애브서틴주는 1형 고셔병 적응증만 허가받은 상태다. 이수앱지스는 해당 파이프라인을 통해 적응증 확장, 희귀질환 치료제 국산화, 글로벌 상용화를 추진하고 있다.
에스엔이바이오는 급성 뇌경색 환자를 대상으로 엑소좀 기반 신약후보 'SNE-101' 임상 1상을 승인받았다. SNE-101은 제대혈 유래 중간엽 줄기세포(MSC)에서 유래한 엑소좀에 마이크로 RNA를 탑재해 뇌세포 재생과 회복을 유도하는 기전을 갖고 있다. 엑소좀 기반 치료제는 재생의학 분야에서 차세대 치료제로 주목받고 있다.
지아이바이옴은 저위전방절제술 증후군(LARS) 환자를 대상으로 마이크로바이옴 치료제 후보 'GB104' 임상 2a상을 승인받았다. LARS는 대장암 수술 후 배변 장애를 초래하는 질환이다. 치료제가 부재한 영역에서 GB104는 기능성 마이크로바이옴 기반 치료제로 기대를 받고 있다.
에임드바이오는 진행성 및 전이성 고형암 환자를 대상으로 이중항체 면역항암제 'AMB302' 임상 1상을 승인받았다. AMB302는 T세포 기반 면역반응 유도와 종양 미세환경을 동시에 조절하는 차세대 면역항암제다.
루카스바이오는 조혈모세포 이식 후 항바이러스제 불응성 감염(CMV, BKV, EBV) 환자를 대상으로 다중특이적 T세포 치료제 'LB-DTK-MV' 임상 1/2상을 승인받았다. LB-DTK-MV는 건강한 공여자 유래 면역세포를 가공해 바이러스 제거 기능을 부여한 세포치료제다. 치료 옵션이 제한된 감염성 질환 치료에 새로운 대안으로 부상하고 있다.
인테라는 노로바이러스 예방용 백신 후보물질 'INT101' 임상 1상을 승인받았다. INT101은 재조합 바이러스 유사 입자(VLP) 기반 3가 백신이다. VLP는 바이러스와 같은 모양으로 몸에 들어가면 강력한 면역 반응을 일으킨다. 그러나 실제 바이러스와 달리 유전체가 없어 기존 백신처럼 감염이나 병원성 우려가 적다. 노로바이러스는 다양한 형태가 있고, 특히 항체 유지기간이 짧아 백신 예방에 한계가 있었다.
카인사이언스는 만성 염증성 탈수초 다발신경병증(CIDP) 타깃 'KINE-101' 임상 1상을 승인받았다. KINE-101은 조절 T세포(Treg) 활성을 통해 면역 항상성을 회복하고 염증을 억제하는 펩타이드 기반 약물이다. 조절 T세포는 면역계를 조절, 과민한 면역 반응을 억제하는 기능이 있다.
업계 관계자는 "최근 3개월 연속으로 매달 30건 이상 IND 승인이 이어지고 있는 것은 한동안 침체했던 바이오 신약개발 산업 전반이 다시 활기를 되찾고 있다는 신호"라며 "단순히 초기 임상 진입에 그치지 않고, 과제 다수가 2상과 3상 등 후기 단계로 원활히 진입할 수 있도록 정부 차원의 적극적인 지원이 필요하다"고 분석했다.
|
|
-
01 클래시스, 브라질 최대 미용의료기 유통사 ... -
02 한국바이오협회,회원사 맞춤형 역량강화 실... -
03 미국 진출, 철저한 규제 준수와 준비 필요 -
04 FDA, GLP-1 제제 불법 마케팅 업체들에 경고문 -
05 복지부 이관 앞둔 국립대병원 …742억 인프라... -
06 커지는 희귀질환 시장… 희귀질환 치료제 확... -
07 화이자 CEO “FDA CBER 리더십 문제 있다” 공... -
08 사노피, 중국 시노바이오팜 신약에 15억달러... -
09 K-뷰티 구조적 성장 진행 중…2029년 150억 ... -
10 자동차보험 진료비 논의…"비용 통제보다 환...











