4월 임상 승인받은 기업 6곳뿐…한국MSD 4건 승인
유바이오로직스 대상포진 예방 백신 ‘EuHZV’ 1상 승인

|
지난달 식품의약품안전처로부터 바이오의약품 임상시험 승인을 받은 기업은 6곳에 불과한 것으로 나타났다. 전체 승인 건수도 10건으로 지난 3월 21건에서 반토막 났다. 국내 기업 중에선 유바이오로직스가 임상 1상을 승인 받았다.
약업닷컴(약업신문)이 2일 한국바이오의약품협회 산업동향정보와 식품의약품안전처 의약품통합정보시스템 자료를 분석한 결과, 4월 한 달간(1~30일) 바이오의약품 IND(임상시험계획승인신청서)는 총 10건 승인됐다.
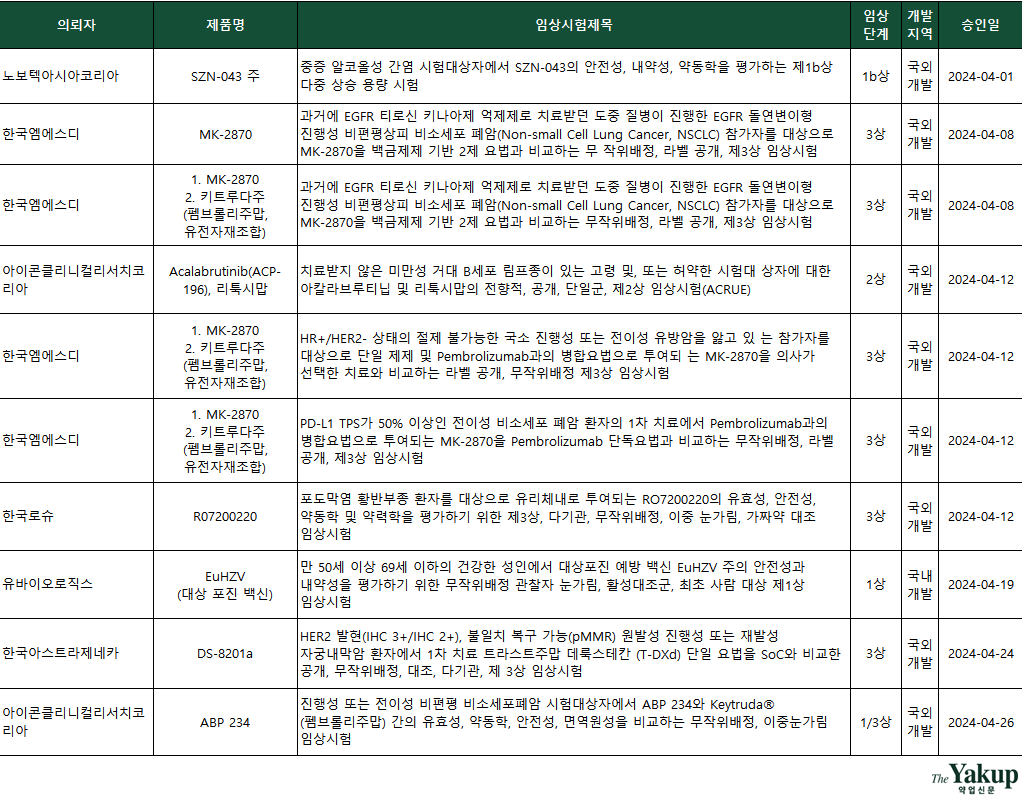
이 중 한국엠에스디가 4건, 아이콘클리니컬리서치코리아(CRO)가 2건씩을 승인받아, 4월에 승인받은 기업은 6곳에 불과했다. 전체 승인된 IND 중 임상 3상이 6건으로 가장 많았다. 이어 1상(1/3상 포함) 3건, 2상 1건 순으로 집계됐다.
임상 3상을 승인 받은 기업은 다국적 제약사와 CRO(임상시험수탁기관)뿐이다. 국내 기업 중에선 유바이오로직스만 임상 1상을 승인받았다. 3상 승인 기업은 △한국MSD △한국로슈 △한국아스트라제네카다.
한국MSD는 4세대 ADC 폐암 신약후보 ‘MK-2870’에 대한 임상만 4건을 승인받았다.
한국MSD는 비소세포폐암(NSCLC) 환자 대상 단독투여 및 키트루다와의 병용투여 임상을 각각 1건씩을 승인받았다. 여기에 ‘HR+/HER2-(호르몬수용체 양성, 인간상피세포수용체2 음성) 상태의 절제 불가능한 국소 진행성 또는 전이성 유방암’ 환자를 대상으로 한 임상 1건과 ‘PD-L1 발현율이 50% 이상인 전이성 비소세포 폐암’ 환자를 대상으로 한 임상 1건도 승인받았다.
MK-2870은 중국 신약개발 기업 켈룬 바이오텍(Kelun Biotech)이 개발한 TROP-2(Trophoblast cell surface antigen 2) 타깃 ADC 신약후보물질이다. MSD(미국 머크)가 2022년 5월 약 14억1000만 달러(약 1조9398억원)에 중국을 제외한 글로벌 권리를 사들였다.
유바이오로직스는 대상포진 예방 백신 ‘EuHZV(유에이치지브이)주’ 1상을 승인받았다. 해당 임상은 50세 이상 69세 이하 건강한 성인에서 72명을 대상으로 진행된다. 임상 예상 종료일은 2025년 12월이다. 유바이오로직스는 이번 임상이 안전성과 유효성을 탐색하는 차원인 만큼, 통계적 유의성 확보를 위한 프로토콜로 설계되지 않았다고 강조했다.
EuHZV는 유바이오로직스의 면역증강 플랫폼 기술 ‘EuIMT’와 미국 출자사 팝바이오테크닉스의 항원 디스플레이 기술 ’SNAP’가 적용됐다. 해당 기술들은 코로나19 백신 ‘유코백19’를 통해 우수성이 증명됐다. 유코백19는 지난해 1월 식약처로부터 수출용 품목허가를 받고, 현재 필리핀에서 허가 과정이 진행 중이다.
|
-
01 앱클론, 차세대 CAR-T 치료제 ‘네스페셀’ 임... -
02 "3년 내 20개" 김용주 대표, 리가켐바이오 A... -
03 씨젠, 감염병 분석 플랫폼 ‘STAgora’ 출시…"... -
04 아이진, 수막구균 4가 백신 ‘EG-MCV4’ 식약... -
05 33일 걸리던 감염병 진단 3일 내 단축 'NGS'... -
06 아트블러드, 최고기술책임자 2인 영입…"체외... -
07 삼일제약, ‘싱귤래리티바이오텍’과 전략적 ... -
08 삼성바이오에피스-한미약품, 골다공증 치료... -
09 리가켐바이오, 파트너사 익수다 'HER2-ADC' ... -
10 씨엔알리서치, 400억원 규모 ‘유안타인베스...











