
|
식품의약품안전처가 지난달 승인한 IND(임상시험계획승인신청서) 중 국내 기업 세 곳이 항암제 개발에 도전하는 것으로 나타났다. 삼성바이오에피스, 동아에스티, 한독이 그 주인공이다. 항종양 임상시험은 난도가 높고, 비용도 배로 들지만, 시장 규모가 매우 거대해 성공만 하면 큰 이익을 얻을 수 있다.
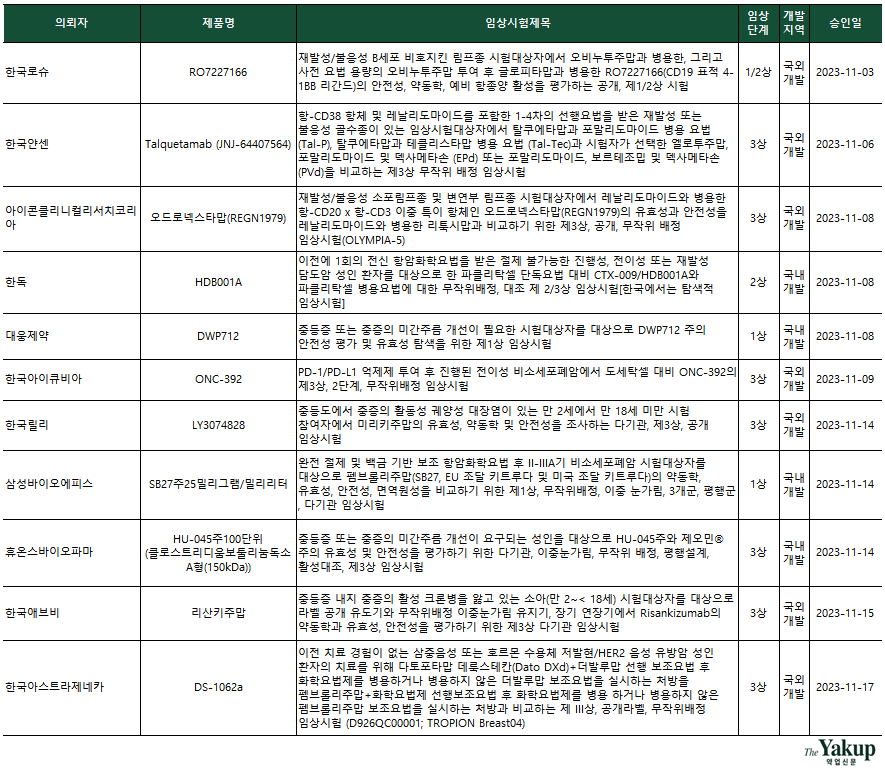
약업닷컴(약업신문)이 4일 한국바이오의약품협회 산업동향정보와 식약처 의약품통합정보시스템 자료를 분석한 결과, 지난 11월 한 달간(1일~30일) 바이오의약품 IND는 총 24건 승인됐다.
전체 승인된 IND 중 임상 3상이 10건으로 가장 많았고, 1상 8건과 2상 6건 순으로 집계됐다. 특히 이달에는 국내 기업 두 곳도 3상을 승인받았다. 3상 승인 국내 기업은 △휴온스바이오파마 △제넥신이다. 이외 다국적 기업 중 △한국얀센 △아이콘클리니컬리서치코리아(CRO, 임상시험수탁기관) △한국아이큐비아(CRO) △한국릴리 △한국애브비 △한국아스트라제네카 △파머수티컬리서치어소시에이츠코리아(CRO)가 3상을 승인받았다. 이 중 한국아이큐비아는 3상 2건을 승인받았다.
|
특히 이달엔 항종양 관련 임상시험이 12건 승인돼 전체 24건 중 절반에 달했다. 이 중 4건은 3상이었다. 특히 국내 기업 삼성바이오에피스, 동아에스티, 한독이 항종양 관련 임상을 승인받으며 항암제 개발을 본격화 했다. 한독은 2상, 삼성바이오에피스와 동아에스티는 각각 1상(1/2a상)을 승인받았다.
삼성바이오에피스는 면역항암제 대표 블록버스터인 키트루다 바이오시밀러 'SB27' 개발을 위한 1상을 승인받았다. 삼성바이오에피스는 치료를 진행한 비소세포폐암 환자를 대상으로 키트루다와 'SB27' 간 동등성을 평가할 계획이다. 이번 1상에선 안전성과 약동학을 포함한 유효성과 면역원성도 평가할 예정이다. 이 임상은 서울대학교병원, 삼성서울병원, 차의과학대학교분당차병원 포함 9개 사이트가 계획돼 있다.
동아에스티는 고형암 타깃 'DA-4505' 단독요법 및 키트루다 병용요법 임상 1/2a상을 승인받았다. DA-4505는 AhR(Aryl Hydrocarbon Receptor, 아릴탄화수소수용체)을 저해해 종양미세환경(TME)에서 억제된 면역반응을 복구시키는 특정이 있다. AhR은 면역계 조절 인자로 면역반응을 억제하고 종양세포 공격을 방지하는 작용을 보인다. 즉 동아에스티는 AhR를 억제해 종양세포의 방패를 뚫는 항암제를 개발하는 것이다.
한독이 승인받은 HDB001A 2상은 미국 콤패스 테라퓨틱스의 글로벌 2/3상에 참여하는 형태다. HDB001A의 2/3상은 한국과 해외 35여개 기관에서 150명 환자를 대상으로 진행될 예정이다. 특히 HDB001A는 에이비엘바이오의 이중항체 플랫폼 기술이 적용된 항암 신약후보물질로, 에이비엘바이오가 한독과 콤패스 테라퓨틱스에 각각 기술이전했다.
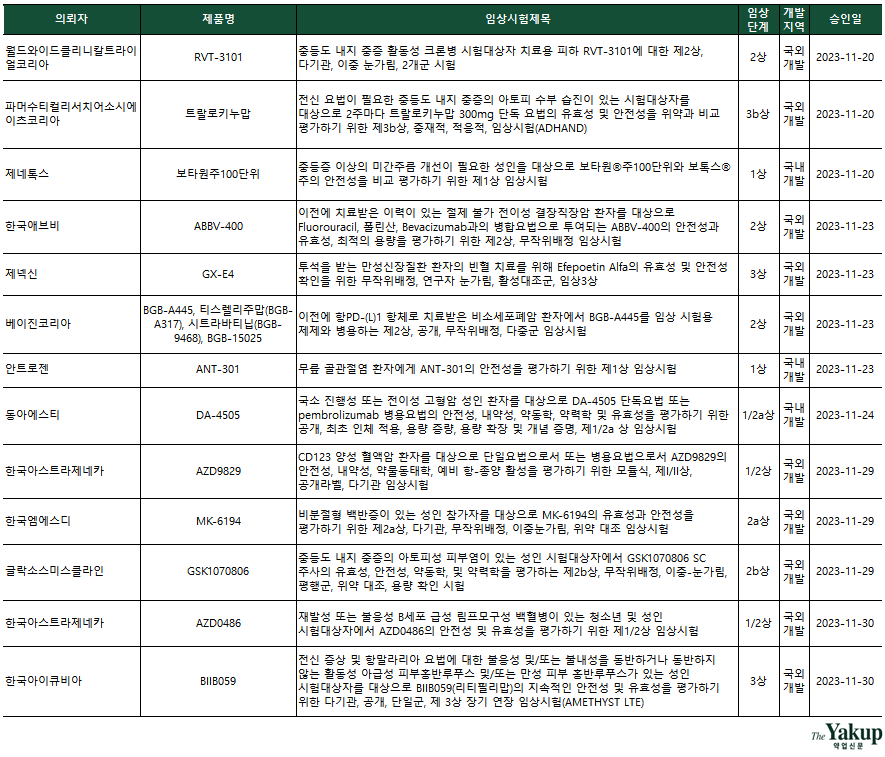
이달에 3상을 승인받은 제넥신은 지속형 신성빈혈치료제 ‘GX-E4’를 국내뿐만 아니라 유럽 및 아시아 총 11개국에서 진행할 예정이다. GX-E4는 제넥신의 지속형 플랫폼 기술 'hyFc®'가 적용, 1회 투여로도 장기간 효과를 내는 것이 강점이다. 휴온스바이오파마는 보톡스로 통칭되는 미간주름 개선 치료제 'HU-045'의 3상을 진행할 예정이다. 휴온스바이오파마는 멀츠아시아퍼시픽피티이엘티디의 ‘제오민주’를 대조약으로 선정했다. 여기에 대웅제약과 제네톡스도 미간주름 개선 치료제 개발을 위한 1상을 승인받았다.
이밖에 △크론병 △아토피 △무릎 골관절염 △백반증 △피부홍반루푸스 등을 적응증으로 하는 IND가 승인됐다.
|
-
01 오스코텍,차세대 항암신약 'OCT-598' 임상1... -
02 고령층 폐렴, 중등도 이상 65%…심평원 "진료... -
03 CJ올리브영, 북미 최대 뷰티 박람회 '코스모... -
04 딥큐어, 복강경 RDN '하이퍼큐어' 심방세동... -
05 범부처재생의료기술개발사업단-국가독성과학... -
06 에이치이엠파마, 세종공장 준공…“글로벌 헬... -
07 SK바사-사노피 공동개발 폐렴구균 단백접합 ... -
08 경동제약,제제 기술력 기반 제네릭 개발 강... -
09 삼성바이오에피스, 미국 해로우와 안과질환 ... -
10 여름 휴가 때 챙겨야 할 필수 상비약은?











