
|
지난달 국내 바이오의약품 임상시험은 글로벌 빅파마가 이끌었다. 전통 제약사와 바이오텍의 특색있는 협업도 돋보인다.
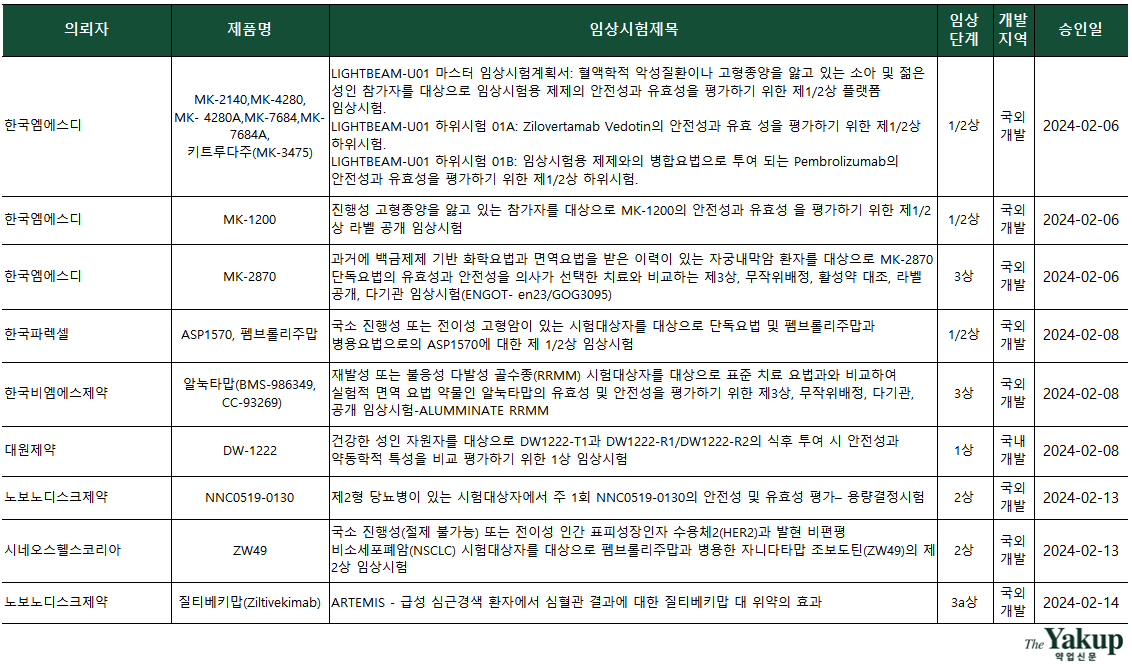
약업닷컴(약업신문)이 5일 한국바이오의약품협회 산업동향정보와 식품의약품안전처 의약품통합정보시스템 자료를 분석한 결과, 지난 2월 한 달간(1일~29일) 바이오의약품 IND(임상시험계획승인신청서)는 총 19건 승인됐다. 전체 승인된 IND 중 임상 3상이 9건으로 가장 많았고, 1상 6건과 2상 4건(2/3상 포함) 순으로 집계됐다.
국내 기업 중 임상 3상을 승인받은 곳은 단 한 곳도 없었다. 다국적 제약사가 임상 3상을 다수 승인받았고, CRO(임상시험수탁기관)가 승인받은 IND도 모두 국외개발 건이다.
3상 승인 기업은 △한국엠에스디 △한국비엠에스제약 △노보노디스크제약 △피피디디벨럽먼트피티이엘티디(CRO) △한국아스트라제네카 △파머수티컬리서치 어소시에이츠코리아(CRO) △알렉시온파마다. 이 중 한국엠에스디와 한국비엠에스제약은 3상을 두건씩 승인받았다. 국내 기업 중에선 △대원제약과 △셀라토즈테라퓨틱스가 1상을 승인받았다.
키트루다(성분명 Pembrolizumab, 펨브롤리주맙)와의 병용임상 열풍이 지속됐다. 이 달에만 총 4건의 키트루다 병용투여 IND가 승인됐다. 특히 한국엠에스디는 직접 혈액암 또는 고형암을 앓는 소아 및 청년을 대상으로 한 키트루다 병용 1/2상 IND를 승인, 적응증 확장에 집중하는 것으로 나타났다. 이 외에도 비소세포폐암, 요로상피세포암 등 고형암 타깃을 중점으로 하는 키트루다와의 병용임상이 승인됐다.
|
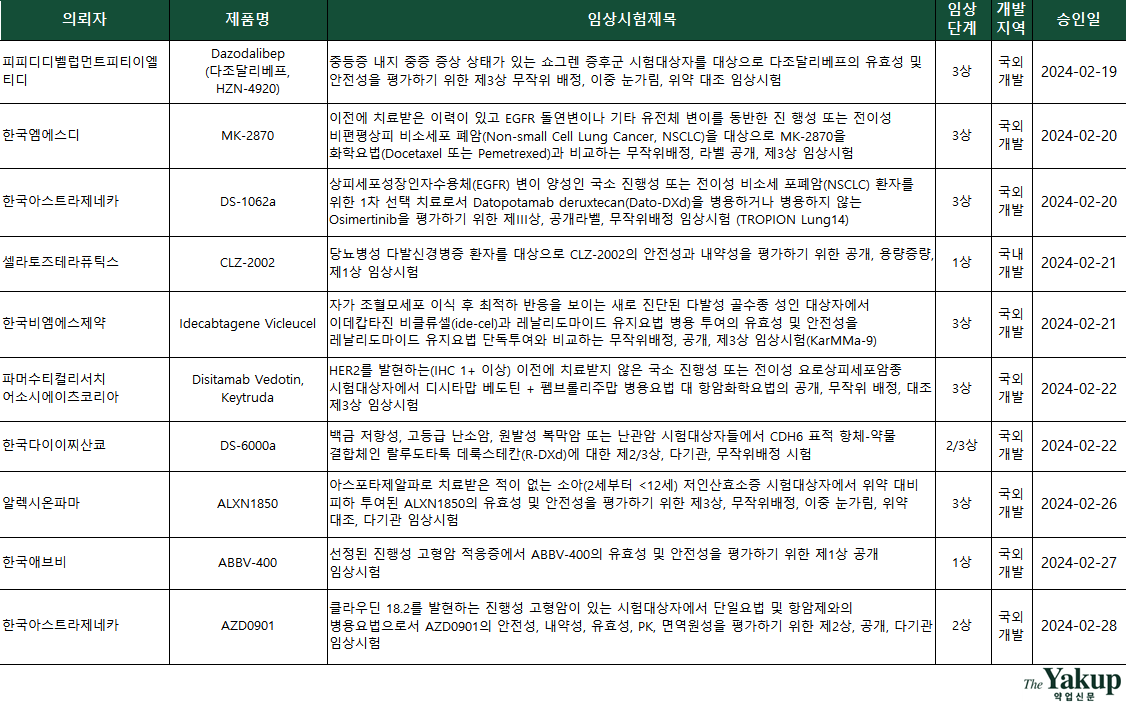
케미컬의약품 강자 대원제약과 마이크로니들 DDS(drug delivery system, 약물전달시스템) 바이오텍 라파스가 특색있는 협력을 모색한다.
대원제약은 붙이는 비만치료제 'DW-1222' 임상 1상을 승인받았다. 양사는 노보 노디스크 위고비의 유효성분 '세마글루티드'를 사용해 마니크로니들 패치제로 개발할 계획이다. 임상 1상은 대원제약이 주관하기로 했다.
대원제약은 유전자재조합 물질인 세마글루티드를 합성펩타이드로 전환시켰고, 라파스는 이 유효성분을 마이크로니들 패치 제형으로 개발했다. 이는 유전자재조합 물질을 합성펩타이드로, 주사제를 패치제로 변경하는 신약개발 수준의 프로젝트다. 이러한 고난도 프로젝트가 IND를 승인받았다는 것은 안전성, 유효성 확보와는 별개로, 품목허가와 상업용 생산을 위한 CMC(의약품 공정 개발 및 품질관리)가 어느 정도 갖춰졌다는 의미로 해석할 수 있다. 즉, 개량신약으로서 허가 가능성이 크다는 것이다.
라파스 관계자는 해당 IND를 신청하면서 “DW-1022가 위고비와 동등한 생체 흡수와 효과를 보여 준다면, 기존 주사제의 단점인 통증 유발과 의료폐기물 발생 등의 문제를 개선할 수 있다”라면서 “특히 패치제는 사용자가 간단하게 붙이기만 하면 돼, 사용 편의성에서 강점을 지닐 것”이라고 밝힌 바 있다.
셀라토즈테라퓨틱스는 당뇨병성 다발신경병증 세포치료제 'CLZ-2002' 임상 1상을 승인받았다. 셀라토즈테라퓨틱스는 세포치료제 기반 난치성 질환 신약개발 전문 기업이다. CLZ-2002는 당뇨병성 다발신경병증 외에도 말초신경병증(샤르코 마리 투스 1형) 환자를 대상으로 임상 1상이 진행 중이다. CLZ-2002는 2022년 FDA로부터 유전성 운동 및 신경병증 질환을 대상으로 희귀의약품지정(ODD)을 받았다.
|
-
01 '제6회 희귀유전질환 심포지엄' 참가 사전등... -
02 "제2의 알테오젠·리가켐 키운다" 대전시, '... -
03 알에프바이오, 자체 개발 PN 원료 '미백 - ... -
04 코스닥 상장 도전 프로티나 "‘PPI 빅데이터’... -
05 펩트론, 루프린 제네릭 '1개월 지속형 루프... -
06 앱클론 “AC101 임상3상 순항..미국 HER2 양... -
07 "돌봄은 국가의 책임"...전국민 장기요양보... -
08 식약처, K-뷰티 수출경쟁력 제고 위한 규제... -
09 대한민국약전, 국제 약전토론그룹 회원 후... -
10 SK플라즈마, 안동시와 혈장분획제제 인프라 ...











