전단계 8건씩 동일…3상, 1곳 외 다국적 제약사·글로벌 CRO
로피바이오 아일리아 시밀러 대전 합류, 온코닉테라퓨틱스 파이프라인 확장 총력

|
지난달 올해 처음으로 국내 기업이 개발한 바이오의약품이 임상시험 3상 IND(임상시험계획승인신청서)를 승인받는 데 성공했다. 국내 기업의 난치성 항암 신약과 희귀유전질환 신약 개발 도전도 이어졌다.
약업닷컴(약업신문)이 7일 한국바이오의약품협회 산업동향정보와 식품의약품안전처 의약품통합정보시스템 자료를 분석한 결과, 6월 한 달간(1~30일) 바이오의약품 IND는 총 18건 승인됐다.
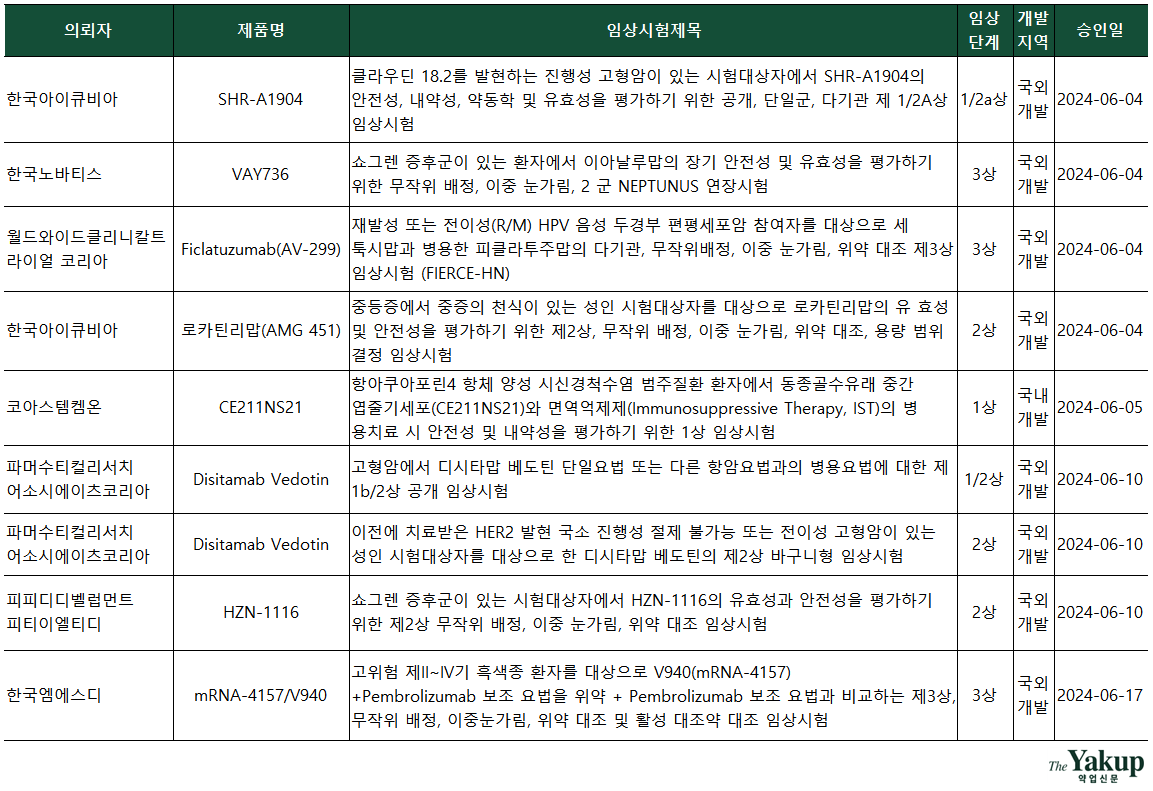
전체 승인된 IND는 단계별로 6건으로 같았다. 특히 3상을 승인받은 기업에 국내 기업 로피바이오 1곳이 포함됐다. 이 외 5곳은 모두 다국적 제약사와 글로벌 CRO(임상시험수탁기관)로 집계됐다. 3상 승인 기업은 △한국노바티스 △월드와이드클리니칼트라이얼코리아(CRO) △한국엠에스디 △한국파렉셀 △한국애브비 △로피바이오다.
6월에도 승인된 IND 중 항암제 개발 임상시험이 다수를 차지했다. 전체 중 10건이 항종양 타깃 임상으로 분석됐다. 특히 최근 대규모 라이선스 거래로 주목받은 독일 머크가 기술이전한 중국 항서제약(Jiangsu Hengruio Pharmaceuticals·江蘇恒瑞醫葯)의 ADC(항체약물접합체) 신약후보 'SHR-A1904'가 국내 1/2a상을 승인받았다. 해당 임상은 한국아이큐비아가 담당하며, 진행성 고형암 환자를 대상으로 SHR-A1904의 안전성, 유효성 등이 평가될 예정이다.
머크는 지난해 10월 항서제약의 'SHR-A1904' 등, 신약 파이프라인 라이선스 거래를 위해 선급금만 1억6000만 유로(약 2397억원), 최대 14억 유로(2조981억원) 규모에 달하는 계약을 체결했다. SHR-A1904는 클라우딘18.2(Claudin18.2) 항원을 타깃하는 ADC 신약 후보다. 클라우딘18.2은 고형암, 특히 위암 및 췌장암 등에서 과발현되는 것으로 알려져, 미충족 의료 수요가 큰 해당 암종의 대안으로 주목받고 있다.
로피바이오 이외에 국내 기업 코아스템켐온(1상), 이엔셀(1/2a상)과 국내 병원 세브란스병원(2상), 삼성서울병원이 IND를 승인받았다. 이 중 삼성서울병원(2상)은 국내 개발이 아닌 로슈의 CAR-T를 학술 연구 목적으로 하는 임상을 승인받았다.
올해 첫 국내 개발 바이오의약품 임상 3상 IND 승인이 나왔다. 아미코젠 관계사 로피바이오는 지난달 28일 아일리아 바이오시밀러 'RBS-001'를 신생혈관성(습성) 연령 관련 황반변성이 있는 환자를 대상으로 하는 3상을 승인받았다. 이로써 로피바이오는 FDA, EMA에 이어 식약처에도 IND를 승인받고, 글로벌 아일리아 바이오시밀러 대전에 본격적으로 합류하게 됐다.
로피바이오 관계자는 “RBS-001의 3상 완료 시점을 2025년 12월로 예상하고 있다”면서 “라이선스 아웃 로열티 이외 바이오시밀러 상업화에 따른 매출은 미국 품목허가신청(BLA) 후 2026~2027년부터 본격화될 것”이라고 밝혔다. 로피바이오는 아일리아 상업화를 기반으로 2026년 코스닥 상장도 목표로 세웠다.
|
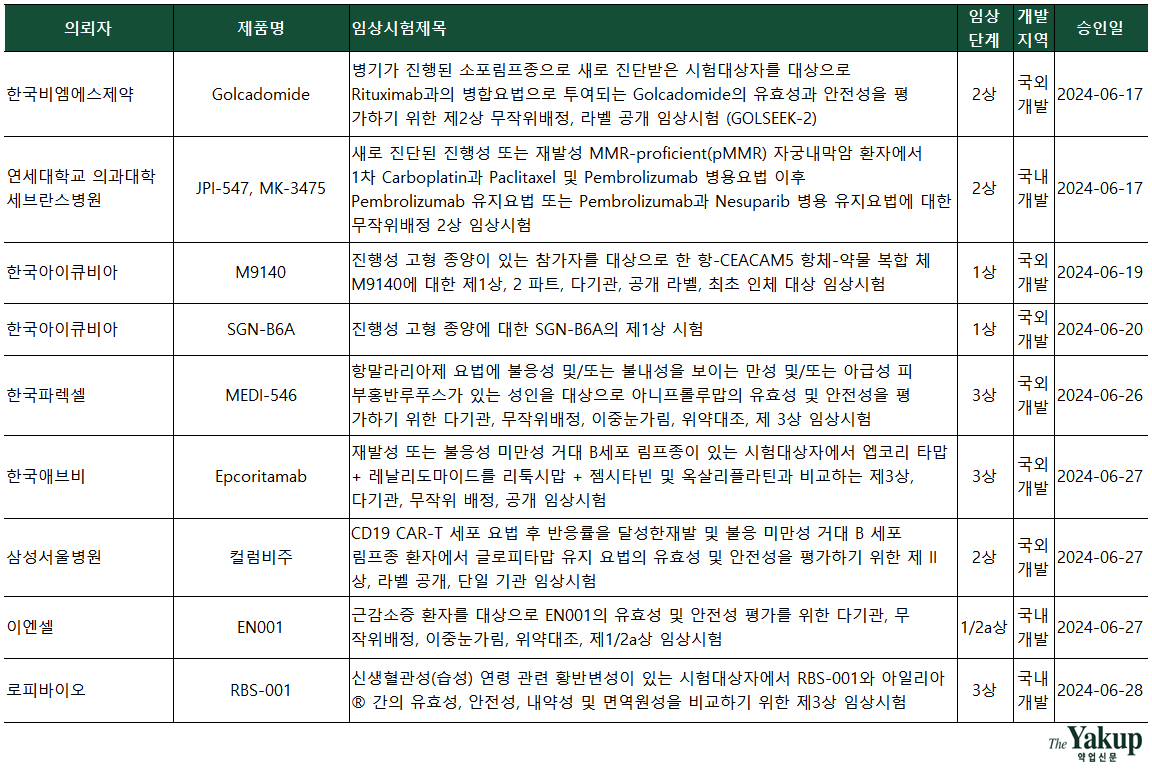
세브란스병원은 학술 연구용으로 제일약품 신약개발 자회사 온코닉테라퓨틱스의 이중저해 표적항암제 ‘네수파립(Nesuparib)'을 자궁내막암 치료 목적으로 면역항암제와 병용 투여하는 2상을 승인받았다.
세브란스병원은 이번 임상을 학술 연구용으로 승인받았지만, 임상 모집 환자 수가 92명으로 설정된 만큼, 온코닉테라퓨틱스는 다방면으로 네수파립 품목허가에 도전 중인 것으로 나타났다. 네수파립은 이미 2022년 6월 식약처로부터 난소암 단독요법 임상을 승인받고 현재 2상을 진행 중이다.
세브란스병원은 새로 진단된 진행성 또는 재발성 pMMR(불일치복구능숙) 자궁내막암 환자에서 1차 파라플라틴(성분명: Carboplatin)과 파덱솔주(성분병: Paclitaxel) 및 키트루다(성분명: Pembrolizumab) 병용요법을 진행한다. 이후 키트루다 유지요법 또는 키트루다와 네수파립 병용 유지요법을 수행할 계획이다.
네수파립은 파프(PARP)와 탄키라제(Tankyrase)를 동시에 저해하는 이중 기전의 표적 항암제(PARP/TNKS dual inhibitor)다. 1세대 파프 억제제 치료 후 내성 문제를 해결할 수 있는 항암제로 평가받고 있다. 네수파립은 지난 2021년 FDA와 식약처로부터 췌장암 치료에 대한 희귀의약품지정을 받고, 미국과 한국에서 췌장암 임상 1b상도 진행 중이다.
이엔셀은 근감소증 신약후보 'EN001'의 임상 1/2a상을 승인받았다. 이번 임상을 통해 이엔셀은 근감소증 환자를 대상으로 EN001의 안전성, 유효성 등을 평가할 예정이다. EN001은 이엔셀의 플랫폼 기술이 적용된 차세대 동종탯줄 유래 중간엽줄기세포를 기반으로 근육 관련 희귀유전질환 치료제로 개발 중이다. 현재 샤르코마리투스병(CMT)과 듀센 근디스트로피(DMD) 임상이 진행되고 있다. 특히 샤르코마리투스병 임상 1상에서 유의미한 개선 효과가 확인돼 다른 적응증에서도 기대를 받고 있다.
이엔셀은 지난 2018년 삼성서울병원 장종욱 교수가 교원 창업한 기업으로 세포·유전자치료제 위탁개발생산(CDMO) 및 신약 개발 전문기업이다. CDMO 사업에선 17개 고객사, 33개 프로젝트가 진행 중이다. 이를 통해 누적 242억원의 매출을 기록했다. 이엔셀은 코스닥 상장을 위한 증권신고서를 금융위원회에 제출하고 본격적인 상장 절차를 밟고 있다. 빠르면 8월 상장할 예정이다.
코아스템켐온은 항아쿠아포린4 항체 양성 시신경척수염 범주질환 환자에서 동종골수유래 중간엽줄기세포 ‘CE211NS21’와 면역억제제(Immunosuppressive Therapy, IST) 병용 치료 시 안전성 및 내약성을 평가하기 위한 1상 IND를 승인받았다. 이번 임상은 시신성 척수염 환자 6~12명을 대상으로 국내 4개 병원에서 진행되며, 2027년 8월 종료될 예정이다.
|
-
01 오스코텍,차세대 항암신약 'OCT-598' 임상1... -
02 고령층 폐렴, 중등도 이상 65%…심평원 "진료... -
03 CJ올리브영, 북미 최대 뷰티 박람회 '코스모... -
04 딥큐어, 복강경 RDN '하이퍼큐어' 심방세동... -
05 범부처재생의료기술개발사업단-국가독성과학... -
06 에이치이엠파마, 세종공장 준공…“글로벌 헬... -
07 SK바사-사노피 공동개발 폐렴구균 단백접합 ... -
08 경동제약,제제 기술력 기반 제네릭 개발 강... -
09 삼성바이오에피스, 미국 해로우와 안과질환 ... -
10 여름 휴가 때 챙겨야 할 필수 상비약은?











