뉴스
EMA, 지난해 92개 의약품 판매승인 권고…전년비 소폭 감소
국가신약개발재단, ‘2021년 EMA 승인 권고 현황’ 공개
이주영 기자 │ jylee@yakup.com


입력 2022-03-16 06:00 수정 2022.03.16 06:05
|
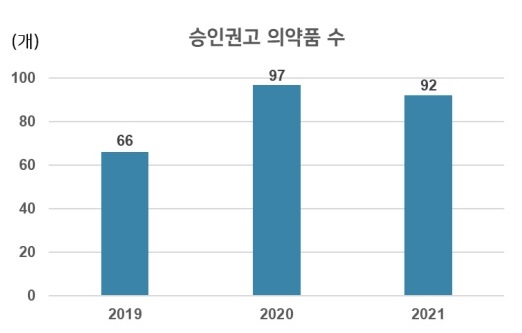
유럽 의약품감독국(EMA)이 지난 한 해 동안 심사를 진행한 결과, 92개 의약품에 대한 판매 승인을 권고한 것으로 나타났다. 이 중 54개는 새로운 유효성분이다.
국가신약개발재단은 15일 ‘2021년 유럽의약품감독국 승인 권고 현황’을 공개하면서 “지난해 EMA가 판매 승인을 권고하는 긍정적인 의견을 낸 의약품은 총 92개로, 전년 수치인 97개보다 소폭 감소했다”고 밝혔다.
재단에 따르면 이 중 54개는 새로운 유효성분으로, 이는 이전까지 EU회원국에서 판매 승인 권고를 받지 않은 성분의 약물이다. 승인 권고를 받은 새로운 유효성분은 2019년 30개, 2020년 39개에 이어 지난해에도 증가한 반면, EMA의 긍정적인 의견을 받은 개량신약 및 바이오시밀러는 2019년 41개, 2020년 36개에 이어 지난해 21개로 감소했다.
또한 지난해 EMA의 승인권고를 받은 희귀질환 의약품은 총 19개로 전체 승인권고 의약품의 21%를 차지하는 것으로 나타났다. 이는 승인권고 희귀질환 의약품 21개, 전체 승인권고 의약품의 23%를 차지한 2020년보다 소폭 감소한 수준이다.
지난해 가속심사가 이뤄진 의약품은 3개이며 조건부 승인 13개, 비상승인 4개로 확인됐다. 새로운 적응증을 허가받은 의약품은 89개로 2020년 83개에 비해 소폭 증가했다.
특히 EMA가 승인을 권고한 의약품의 적응증을 살펴보면 종양군은 22%를 차지해 2020년에 이어 가장 많은 비중을 나타냈다. 신경계질환은 전년대비 228% 증가하며 두 번째로 많은 비중을 차지했다. 코로나 백신‧치료제와 피부질환, 안과질환 역시 전년대비 승인 권고율이 크게 증가했다.
반면 감염질환과 호흡기질환‧알레르기질환은 전년대비 각각 81%, 71% 감소했다. 이는 관련 제약회사들이 최근 코로나 백신‧치료제 개발에 더 집중했기 때문인 것으로 분석됐다.
지난해 EMA가 승인을 권고한 의약품 중 ‘2021 Human Medicine Highlights’ 보고서에서 해당 질환분야에 유의미한 발전을 가져왔다고 평가한 주요의약품은 총 8개로, 이 중 7개가 희귀의약품 지정을 받았고, 4개는 혁신신약으로 나타났다.
EMA가 지난해 승인을 권고한 PRIME 의약품은 6개로, 이 중 BMS의 아베크마(Abecma)와 블루버드 바이오의 스카이소나(Skysona)는 첨단치료의약품으로도 지정됐다. PRIME(Priority medicines)은 현재 치료 옵션이 없거나 기존 치료제에 비해 효과가 뛰어날 것으로 기대되는 의약품에 대해 초기단계부터 지원을 제공하는 제도다.
반면 지난해 EMA가 허가를 권고하지 않은 의약품은 총 5개로 애드유헬름(Aduhelm, 알츠하이머 치료제), 플린포비(Flynpovi, 샘종폴립증 치료제), 이피큐(Ipique, 황반변성 치료제), 누리안츠(Nouryant, 파킨슨병 치료제), 레이루미스(Raylumis, 골관절염 치료제)이다.
이외에도 승인권고가 철회된 의약품은 아자스티딘 세엘진(Azacitidine Celgene, 골수병백혈병 치료제), 에퀴데이선트(Equidacent, 대장암‧난소암 등 치료제), 렉스테미(Lextemy, 대장암‧유방암 등 치료제), 루목시티(Lumoxiti, 털세포백혈병 치료제), 쿠타비나(Qutavina, 골다공증 치료제), 큐트릴메트(Qtrilmet, 제2형 당뇨병 치료제), 스카이소나(Skysona, 부신백질이영양증 치료제) 등 7개다.
국가신약개발재단은 15일 ‘2021년 유럽의약품감독국 승인 권고 현황’을 공개하면서 “지난해 EMA가 판매 승인을 권고하는 긍정적인 의견을 낸 의약품은 총 92개로, 전년 수치인 97개보다 소폭 감소했다”고 밝혔다.
재단에 따르면 이 중 54개는 새로운 유효성분으로, 이는 이전까지 EU회원국에서 판매 승인 권고를 받지 않은 성분의 약물이다. 승인 권고를 받은 새로운 유효성분은 2019년 30개, 2020년 39개에 이어 지난해에도 증가한 반면, EMA의 긍정적인 의견을 받은 개량신약 및 바이오시밀러는 2019년 41개, 2020년 36개에 이어 지난해 21개로 감소했다.
또한 지난해 EMA의 승인권고를 받은 희귀질환 의약품은 총 19개로 전체 승인권고 의약품의 21%를 차지하는 것으로 나타났다. 이는 승인권고 희귀질환 의약품 21개, 전체 승인권고 의약품의 23%를 차지한 2020년보다 소폭 감소한 수준이다.
지난해 가속심사가 이뤄진 의약품은 3개이며 조건부 승인 13개, 비상승인 4개로 확인됐다. 새로운 적응증을 허가받은 의약품은 89개로 2020년 83개에 비해 소폭 증가했다.
특히 EMA가 승인을 권고한 의약품의 적응증을 살펴보면 종양군은 22%를 차지해 2020년에 이어 가장 많은 비중을 나타냈다. 신경계질환은 전년대비 228% 증가하며 두 번째로 많은 비중을 차지했다. 코로나 백신‧치료제와 피부질환, 안과질환 역시 전년대비 승인 권고율이 크게 증가했다.
반면 감염질환과 호흡기질환‧알레르기질환은 전년대비 각각 81%, 71% 감소했다. 이는 관련 제약회사들이 최근 코로나 백신‧치료제 개발에 더 집중했기 때문인 것으로 분석됐다.
지난해 EMA가 승인을 권고한 의약품 중 ‘2021 Human Medicine Highlights’ 보고서에서 해당 질환분야에 유의미한 발전을 가져왔다고 평가한 주요의약품은 총 8개로, 이 중 7개가 희귀의약품 지정을 받았고, 4개는 혁신신약으로 나타났다.
EMA가 지난해 승인을 권고한 PRIME 의약품은 6개로, 이 중 BMS의 아베크마(Abecma)와 블루버드 바이오의 스카이소나(Skysona)는 첨단치료의약품으로도 지정됐다. PRIME(Priority medicines)은 현재 치료 옵션이 없거나 기존 치료제에 비해 효과가 뛰어날 것으로 기대되는 의약품에 대해 초기단계부터 지원을 제공하는 제도다.
반면 지난해 EMA가 허가를 권고하지 않은 의약품은 총 5개로 애드유헬름(Aduhelm, 알츠하이머 치료제), 플린포비(Flynpovi, 샘종폴립증 치료제), 이피큐(Ipique, 황반변성 치료제), 누리안츠(Nouryant, 파킨슨병 치료제), 레이루미스(Raylumis, 골관절염 치료제)이다.
이외에도 승인권고가 철회된 의약품은 아자스티딘 세엘진(Azacitidine Celgene, 골수병백혈병 치료제), 에퀴데이선트(Equidacent, 대장암‧난소암 등 치료제), 렉스테미(Lextemy, 대장암‧유방암 등 치료제), 루목시티(Lumoxiti, 털세포백혈병 치료제), 쿠타비나(Qutavina, 골다공증 치료제), 큐트릴메트(Qtrilmet, 제2형 당뇨병 치료제), 스카이소나(Skysona, 부신백질이영양증 치료제) 등 7개다.
전체댓글 0개
등록된 댓글이 없습니다.
오늘의 헤드라인
-
01 "알테오젠 이을 신흥강자 떴다" 판 흔드는 ... -
02 메디컬에이아이 '의료 AI' 국가전략기술 확인 -
03 "과학자 2700명 모였다" 한국분자·세포생물... -
04 GC녹십자 창립 58주년, ”도전 정신으로 미래... -
05 싸토리우스, 10월 '바이오 DSP 심포지엄' 개... -
06 K-바이오랩허브사업추진단, 첨단재생의료산... -
07 SK바이오사이언스, 영유아 RSV 예방 항체주... -
08 셀트리온, UEGW 2025서 ‘램시마SC’ 장기 임... -
09 알리코제약, '알듀카정' 앞세워 650억 고... -
10 SK바이오팜, 역대 최대 실적 기틀 마련 미국...











