뉴스
바이오약 '시판후 안전관리 방안' 연구 추진…2020년 완료
RWD·RWE 기반 식약처 과제…성대약대 등 국내·외 연구진 참여
이승덕 기자 │ duck4775@yakup.com


입력 2019-06-04 06:00 수정 2019.06.07 15:30
바이오의약품에 대한 시판 후 안전관리 방안과 로드맵을 마련하기 위한 연구가 추진되고 있어 주목된다.
신주영 성균관대학교 약학대학 교수는 약업신문을 통해 올해 2월부터 진행되고 있는 '리얼월드 데이터를 활용한 바이오의약품 시판 후 안전관리를 위한 해외사례와 국내자료 활용 시범연구'를 소개했다.
|
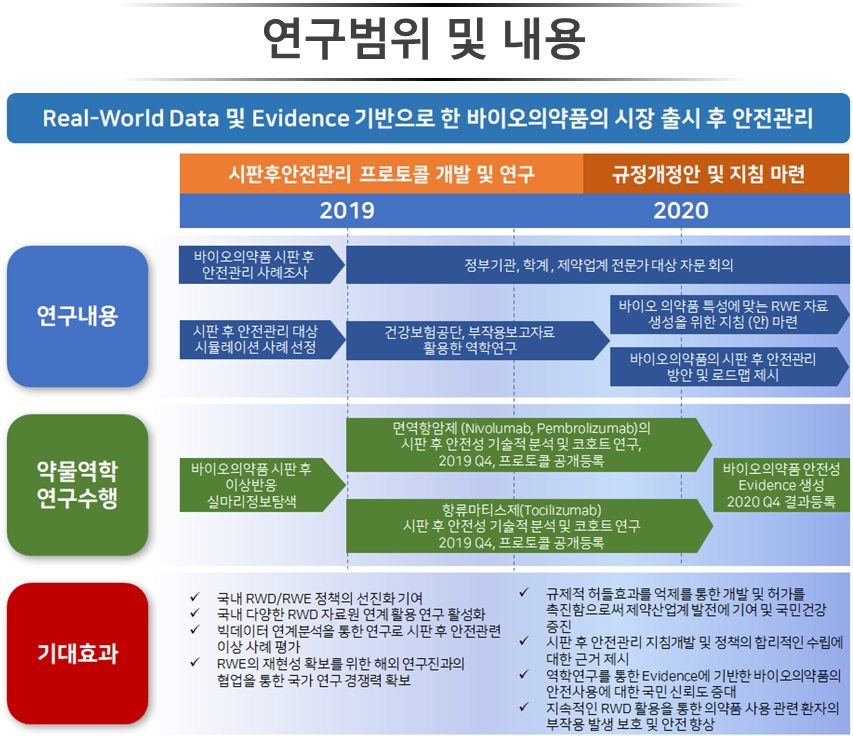
식약처 과제로 2020년 11월 30일까지 진행되는 이번 연구는 바이오의약품의 시장 출시 후 안전관리 기반을 마련하기 위해 계획됐다.
연구진은 실제임상자료(Real World Data, RWD) 및 실제임상증거(Real World Evidence, RWE)를 기반으로 바이오 의약품 특성에 맞는 'RWE 자료 생성 지침(안)'을 마련하고, '시판 후 안전관리 방안 및 로드맵'을 제시한다.
참여하는 연구진은 국내에서는 성균관대 약대 약물역학교실(신주영)을 비롯해 공단일산병원 종양내과(홍수정)가, 해외에서는 캐나다 맥길대학교 암역학/약물역학(로한 아쥴레이), 미국 하버드대학교 류마티스내과/약물역학(김서영)이다.
연구진은 바이오의약품의 RWE 활용 해외사례 조사를 위해 미국, 유럽, 일본, 한국에서 기허가된 바이오의약품과 RWD를 활용한 시판 후 안전관리 사례를 조사한다.
더불어 안전성 관련 증례보고가 있는 바이오의약품을 시판 후 안전성 평가 시뮬레이션 사례로 선정해 이상반응과의 인과성 평가를 위한 약물역학 연구를 수행한다.
건강보험공단자료를 활용한 시뮬레이션 사례로는 비교적 최근에 시판되어 안전성 정보가 확증되지 않은 면역항암제(니볼루맙, 펨브롤리주맙, 아테졸리주맙)와 생물학적 항류마티스제(토실리주맙)를 선정했다.
이들에 대해 신 교수는 "전세계적으로 사용되는 약물이므로 약물역학연구 수행에 적합한 RWD가 존재한다"며 "시판 후 안전성에 대해 통계적, 역학적, 임상적 타당성 확보를 위해 건강보험 전수자료를 활용하고, 재현성 확인을 위해 타국가와 공동연구를 진행하고 있다"고 설명했다.
연구진은 세포독성항암제 및 표적항암제와 비교했을 때, 면역항암제의 면역관련 이상반응 발생위험과, TNF-억제제 대비 토실리주맙의 암 발생위험을 평가하게 된다.
신주영 교수는 "시범연구를 통해 공개 프로세스를 수립해 바이오 의약품 특성에 맞는 RWE 자료 생성을 위한 지침(안)을 마련할 것"이라며 "이는 현 시판 후 조사 제도(PMS)의 한계를 보완하고, RWE가 바이오의약품의 규제 결정에 적절하게 사용될 수 있는 기반 마련에 기여할 것으로 기대된다"고 밝혔다.
한편, 신주영 교수는 이 같은 내용은 지난달 23일 대한약물역학위해관리학회 제23회 학술대회·연수교육에서도 설명한 바 있다.
[관련기사]
근거 기반 의학 시대…‘RWD·RWE’ 중요성 커진다
2018-07-04 06:30
전체댓글 0개
등록된 댓글이 없습니다.
오늘의 헤드라인
-
01 상장 제약바이오,올해도 고환율 직격탄...상... -
02 미국, 백신 안전성 논의 본격화…제약사 주가... -
03 [인터뷰] "한국 뷰티 기업, 유럽 진출 원한... -
04 K-뷰티, 바이어 발굴이 최우선 과제 -
05 미국 민간투자사, 사노피서 인수 제네릭 기... -
06 K-뷰티, 미국 시장 확장기…소비자 여정 설계... -
07 동아대병원 문전약국 판결, 약사·한약사 직... -
08 국내 대표 유전체 기업 지니너스·이노크라스... -
09 서울에 모인 한·중 제약바이오 리더들…"전략... -
10 "유전체데이터 혁신 앞장" NDS, 'AWS 퍼블릭...











