뉴스
대세는 '마이크로바이옴'…②엎치락뒤치락 개발 경쟁
美 세레스테라퓨틱스 BLA 신청으로 선두, 韓 고바이오랩·지놈앤컴퍼니 글로벌 임상 2상 진행 중
권혁진 기자 │ hjkwon@yakup.com


입력 2022-11-22 06:00 수정 2023.01.20 16:39

|
마이크로바이옴 치료제의 성공 가능성이 높아지면서 관련 기업들이 선두를 차지하기 위해 전력을 다하고 있다. 임상시험 진입을 위해 CDMO 계약을 체결하고 기업 간 공동개발에 나서며 임상개발 진행 속도를 끌어올리는 모양새다.
마이크로바이옴(Microbiome)은 미생물과 생태계 합성어로, 인체 내 공생하는 모든 미생물 군집 또는 군집의 유전정보 전체를 말한다. 일각에서는 제2의 장기라고까지 평가한다. 최근 전 세계적으로 마이크로바이옴이 질병의 완화뿐만 아니라 다양한 치료에까지 직접적인 영향을 미친다는 연구결과들이 발표되며, 관련 연구와 임상시험이 급속도로 증가하고 있다.
|
△국가생명공학정책연구센터 바이오인더스트리 No.174-마이크로바이옴 R&D 및 산업화를 위한 전략.
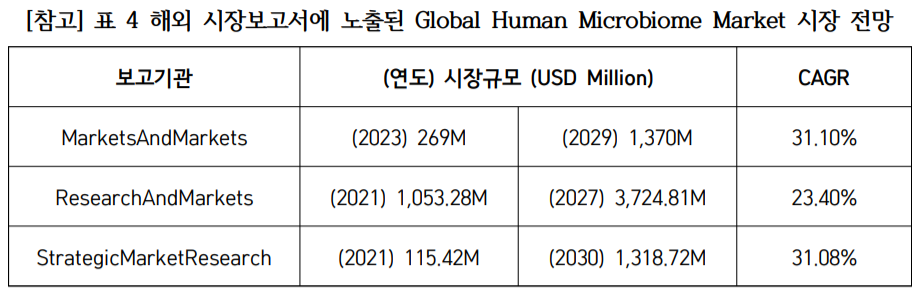
글로벌 시장조사기관 마켓앤드마켓(MarketandMarkets)은 인간 마이크로바이옴 시장이 2023~2029년까지 연평균성장률(CAGR) 31.1%로 예상되며, 시장 규모는 오는 2023년 2억6,900만 달러(3,650억 원)에서 2029년 13억7,000만 달러(1조8,600억 원) 규모로 성장할 것이라고 전망했다.
특히 마이크로바이옴 치료제가 주목받는 이유는 우수한 안전성과 여러 메커니즘을 통한 다중표적 치료가 가능하기 때문이다. 다른 치료제의 모달리티(Modality) 대비 실패 위험 요소가 적고, 제조가 간단하다는 점도 장점이다. 또한 미국 세레스테라퓨틱스(SERES Therapeutics)가 세계 최초로 마이크로바이옴 치료제 임상 3상에 성공하며 마이크로바이옴 치료제 성공 가능성의 포문을 열었다는 평가다.

|
SER-109는 임상 3상에서 재발성 장질환(Clostridioides difficile Infection, CDI)의 재발률을 위약 대비 30.2% 감소시켜 유효성을 입증했다.

|

|
이외에도 지놈앤컴퍼니는 마이크로바이옴 치료제 파이프라인으로 △SB-121(뇌질환 및 소화기 질환) △GEN-004(산과질환) △GEN-501(피부질환)을 개발 중이다.

|
FD1R는 전임상 연구에서 장으로 전달된 B. longum RAPO가 류마티스관절염을 일으키는 면역세포(Th17)의 분화를 억제하고, 염증을 억제하는 면역조절세포(Treg)의 분화를 촉진하는 등 면역조절을 통해 류마티스관절염의 발현, 연골 손상 등을 효과적으로 개선하는 것이 확인됐다. 이 결과는 국제 학술지 Frontiers in Immunology에 게재될 예정이다.
비피도는 FD1R를 자가면역질환인 쇼그렌증후군, 루프스, 강직성척추염 등의 치료제로 개발하기 위한 연구도 진행 중이다.

|
에이투젠은 LABTHERA-001가 질 내 마이크로바이옴을 건강하게 회복시켜 세균성 질염을 안전하고, 근본적으로 치료할 수 있다고 설명했다. 임상 1상은 내년 5월 마무리될 예정이다.

|
여기에 CJ바이오사이언스(천랩), 디엑스앤브이엑스, 브이원바이오, 비엘, 종근당바이오, 메디오젠, 엔테로바이옴, 에이치이엠파마, 디씨엔바이오 등이 마이크로바이옴 기반 치료제를 개발 중이다.
[관련기사]
대세는 '마이크로바이옴'…①질병과 인과관계 입증
2022-11-17 06:00
전체댓글 0개
등록된 댓글이 없습니다.
오늘의 헤드라인
-
01 "확장과 변화, 경계를 넘어" 제20회 경기약... -
02 차바이오텍 CGT 날개 단다㊦ 엑소좀으로 난... -
03 차바이오텍 CGT 날개 단다㊤ 아이디어 하나... -
04 건강기능식품은 내수 전용, 인식 벗을까? -
05 휴온스그룹, 창립 60주년…글로벌 헬스케어 ... -
06 프로젠, 유럽 당뇨병학회서 'PG-102' 연구성... -
07 미국 FDA, 의약품 '보안요구서한'(CRL) 202... -
08 뉴로핏 "10년간 뇌질환 영상 진단만 팠다…26... -
09 옵디보·여보이, 간세포암 1차 치료 대한 적... -
10 “살아남을 시간이 없다”… 빌로이, 전이성 위...











