뉴스
메지온, 폰탄치료제 ‘jurvigo’ 내년 4Q 유럽 조건부승인 신청
"미국 FDA 추가 임상 승인 나면, 내용 추가 유럽 완전한 승인 진행"
이권구 기자 │ kwon9@yakup.com


입력 2024-12-20 09:30 수정 2024.12.20 10:49
|
폰탄치료제 ‘jurvigo’ 미국 FDA 승인을 추진 중인 메지온이 유럽 신약 허가 승인 추진 일정을 공개했다.
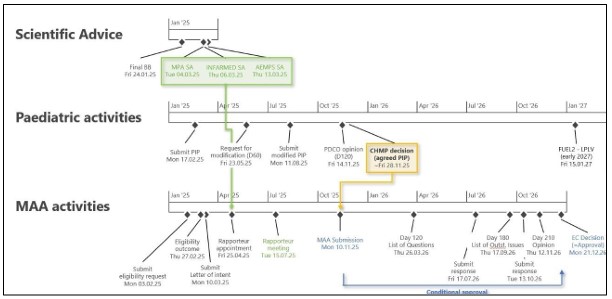
20일 메지온 ‘유럽 NDA 추진 현황’에 따르면 먼저 심혈관 계통 혹은 소아과 신약 허가에 우호적인 EU국가를 선별(3개국 정도)하고 각 국가 Scientific Advice(SA)에Briefing Package를 준비해 제출, 내년 2-3월 선별된 각 국가 SA 개최를 예상하고 있다.
동시에 Pediatric Committee(PDCO)에 제출할 Pediatric Investigation Program(PIP)를 준비하며, 준비된 서류에 대한 PDCO 판단 여부는 내년 4분기 경을 예상하고 있다.
이러한 과정이 완료되면 EMA에 Marketing Authorization Application(MAA)를 진행하기 위해, 조사 위원(Rapporteur)지정과 미팅을 거치게 되며, 이후 준비된 서류를 기반으로 조건부 승인(Conditional Approval)을 신청하게 된다. 회사는 시기를 2025년 4분기로 예상하고 있다.
회사 관계자는 " 약 1년 정도 검토가 모두 완료된 후 조건부 승인을 득하게 되면 유럽에서 신약 판매가 가능하게 된다"며 “이후 미국 FDA의 FUEL-2에 대한 승인이 나면, 그 내용을 추가해 유럽에서 완전한 승인(Full Approval)을 받고자 한다”고 설명했다.
전체댓글 0개
등록된 댓글이 없습니다.
오늘의 헤드라인
-
01 코스메카코리아, CJ온스타일과 ‘투자형 K-뷰... -
02 코오롱생명, KLS-3021 ‘대량 생산기술’ 신규... -
03 루닛,다이이찌산쿄 '러브콜'… "2개 항암 신... -
04 제이투에이치바이오텍, MASH 신약 임상2a상 ... -
05 에이비프로,셀트리온과 HER2 양성암 치료제... -
06 “한국은 북아시아 혁신 전략 핵심 시장…환자... -
07 “규제의 속도가 산업의 속도”…식약처, 인력·... -
08 의약외품을 발톱무좀 치료제로?…대한약사회,... -
09 보건복지부, '바이오·돌봄'에 올인... 5년 ... -
10 "마약 원료 감기약을 쇼핑하듯?"... 약사회,...











