뉴스
중국의 '면역세포치료제' 급성장…한국 '갈 길 멀어'
9월 기준, CAR-T 2개·PD-1 6개 중국 NMPA 허가
한국 면역세포치료제 대부분 임상시험 준비단계
한국 면역세포치료제 대부분 임상시험 준비단계
권혁진 기자 │ hjkwon@yakup.com


입력 2021-09-24 06:00 수정 2021.09.24 06:25
면역세포치료제 산업에서 중국의 가파른 성장세가 돋보이는 가운데, 국내 면역세포치료제 개발 기업에서도 연구개발에 열을 올리고 있다.
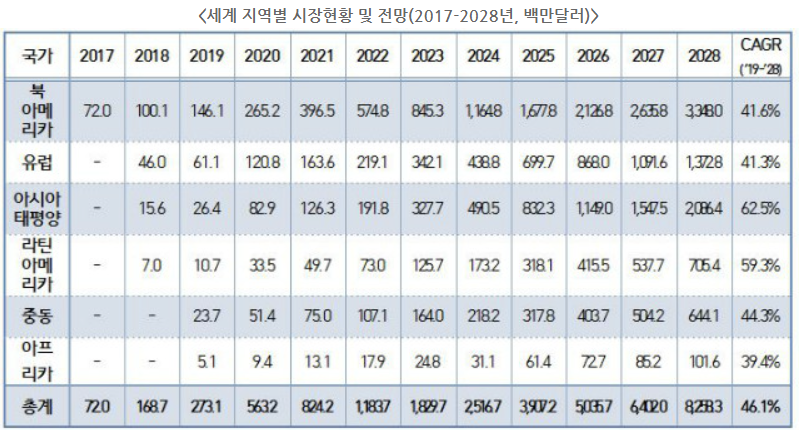
|
지난 6월 중국 Fosun과 미국 Kite Pharma(Gilead)의 조인트벤처인 Fosun Kite Biotechnology의 CAR-T 치료제 'Axicabtagene Ciloleucel'가 최초로 허가받았으며, 지난 3일 중국 WuXi Apptech사와 미국 Juno Therapeutics(BMS)의 조인트벤처인 JW Therapeutics의 CAR-T 치료제 'Relmacabtagene Autoleucel'이 두 번째로 허가받았다.
이로써 중국의 CAR-T 치료제 글로벌 시장의 진출과 경쟁의 심화가 본격적으로 일어날 것이라는 전망이다.
중국의 CAR-T 임상시험 수는 2017년 6월 미국을 추월한 것으로 나타났으며, 2017년 6월 기준, 중국 119개, 미국 112개의 임상시험이 등록됐다. 최근 2020년 6월 30일 기준, 중국 357개, 미국 256개의 임상시험이 등록된 것으로 집계됐다.
한편 한국은 지난 3월 한국노바티스의 CAR-T 치료제 `킴리아(Kymriah, 티사젠렉류셀)`가 식품의약품안전처로부터 허가받은 바 있고, 지난 15일 국민건강보험공단이 킴리아주의 급여등재에 관한 논의를 진행하며, CAR-T 치료제에 대한 환자 접근이 점차 가까워지고 있다.
국내에서는 최근 큐로셀이 지난 2월 식약처로부터 CAR-T 치료제 `CRC01` 임상시험을 승인받아 4월 투약을 개시했으며, 임상 1상에서 최저용량을 투약받은 3명 환자의 1개월 약효평가 결과 2명에게서 완전관해(CR, Complete Response)를 획득했다고 밝힌 바 있다.
또한 앱클론은 지난 6월 난치성 혈액암 타깃의 CAR-T 치료제 `AT101`의 임상시험을 식약처에 신청해 승인을 기다리고 있으며, 비임상시험에서 유의미한 효과를 거둬 임상시험 승인에 가능성이 클 것으로 예상된다. `AT101`은 CD19 단백질을 표적 하는 B세포 유래 혈액암 치료제로 인간화 항체로 개발해 면역원성을 최소화하는 등 기존 CD10 CAR-T 세포치료제에 유효성이 나타나지 않을 때도 효과를 보일 수 있다고 알려져 있다.
이 외에도 GC녹십자셀, 헬릭스미스, 유틸렉스, 코이뮨, HK이노엔 등 다수의 첨단바이오의약품 기업이 연구개발하고 있다.
그러나 한국 기업의 CAR-T 치료제에 대한 승인은 현재까지 없고, 중국과 미국에 비하면 연구개발 및 임상시험 현황이 떨어지는 추세로 나타나 산업 활성화를 위한 범국가적 지원책이 필요하다는 목소리가 높아지고 있다.
중국에서는 CAR-T 연구개발 중인 기업이 Nanjing Legend Biotech, CARsgen, Cellular Biomedicine Group 등을 포함 50개 이상으로 집계됐으며, 특히 Nanjing Legend Biotech은 2020년 8월 중국 NMPA에서 최초로 혁신치료제지정(Breakthrough Therapy Designation) 받았고, 지난 5월 미국 FDA에 우심심사 대상으로 지정받으며 글로벌 CAR-T 산업을 주도하는 모습을 보이고 있다.
또한 중국에서는 지난 8월 기준 면역관문억제제(Programmed Cell Death, PD-1) 6개가 NMPA에 허가받으며, 면역세포치료제 강국으로서 다시 한번 위상을 알렸다.
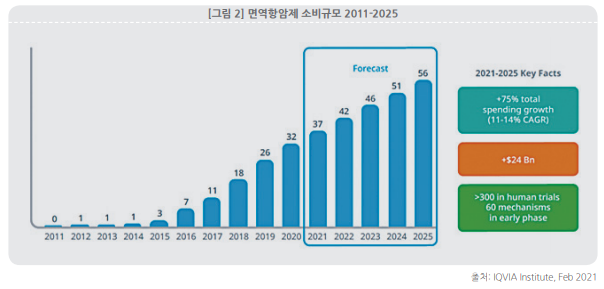
|
이어, 2018년 12월 Innovent Biologics가 미국 일라이 릴리와 공동으로 개발한 'Sintilimab'이 허가받았고, 2019년 5월 Jiangsu Hengrui사가 개발한 'Camrelizumab'이 허가됐다. 또 2019년 12월 BeiGene이 개발한 'tislelizumab'이 허가받았고, 이는 중국에서 자체 생산이 아니라 외자사인 Boehringer Ingelheim을 통해 생산하는 첫 번째 사례로 알려졌다.
최근 지난 8월에는 Akeso/China National Biotech의 'Penpulimab'과 Harbin Gloria Pharmaceutical 및 WuXi Biologics의 'Zimberelimab'이 허가 받았다.
국내에서는 유한양행의 자회사 이뮨온시아가 식약처로부터 임상 2상을 승인받아 진행 중인 면역항암제 `IMC-001`가 대표적이며, IMC-001은 T세포 PD-1과 암세포 PD-L1 간 상호작용에 따른 항암 T세포의 억제 신호를 차단, 항암 T세포 활성을 촉진시켜 항암효과를 높이는 면역관문억제제다.
또한 에이비엘바이오가 지난 8월 식약처로부터 LAG-3과 PD-L1을 동시에 저해하는 면역항암 이중항체 후보물질 'ABL-501'의 임상 1상을 승인받았다. 해당 임상시험에서는 진행성, 국소 진행성 또는 전이성 고형암을 동반한 환자를 대상으로 ABL501의 단독요법에서의 내약성 및 안전성을 평가한다.
이어 제넥신, 와이바이오, 유틸렉스, 지놈앤컴퍼니, 네오이뮨텍, 인트론바이오, 파미셀, 티움바이오, 삼양바이오팜, 바이젠셀 등 다수의 첨단바이오의약품 기업에서 연구개발 및 임상시험을 준비 중이며, 유의미한 연구 결과가 지속해서 발표되고 있어 신약개발의 가능성이 있을 것으로 예상되고 있다.
면역관문억제제도 CAR-T 치료제와 마찬가지로 연구개발 현황이나 임상시험이 중국과 미국에 비해 침체된 양상을 보이고 있고, 또한 개발 중인 후보물질들이 임상 3상을 마치고 상용화까지 상당한 기간이 소요될 전망이다.
업계 관계자는 "면역세포치료제 연구개발 가속화를 위한 경제적 지원 및 민관협의체를 도모하고, 첨단재생의료 및 첨바법(첨단바이오의약품 안전 및 지원에 관한 법률)에 관한 기업의 불편 사항을 수렴해 재개정하는 등, 민관 모두에서 산업 발전을 위해 노력해야 한다"라고 전했다.
전체댓글 0개
등록된 댓글이 없습니다.
오늘의 헤드라인
-
01 서울시약사회, 국회서 대형 유통자본 약국 ... -
02 중증 제2형 염증성 천식, ‘원인 표적 치료’ ... -
03 대한간학회, ‘감염성 간염 관리법’ 발의 당... -
04 한미약품 희귀질환 신약, FDA '혁신치료제' ... -
05 퓨쳐켐, 전립선암 방사성 치료제 ‘FC705’ 국... -
06 인도 정부, 제네릭 위주 탈피 바이오의약품 ... -
07 감염병혁신연합, “AI 플랫폼 '팬데믹 대비 ... -
08 셀트리온, 2025년 매출 4조1625억원, 영업익... -
09 베일 벗은 에이비엘바이오 비장의 카드㊦ si... -
10 베일 벗은 에이비엘바이오 비장의 카드㊤ si...











