
지난 2017년 7월 코오롱생명과학의 무릎 골관절염치료제 '인보사케이주'가 국내 유전자치료제로 첫 허가를 받은 이후 국내 제약 바이오업체들의 유전자치료제 개발 열기가 뜨거워지고 있다.
'유전자치료제'는 '유전물질 발현에 영향을 주기 위하여 투여하는 유전물질' 또는 '유전물질이 변형되거나 도입된 세포' 중 어느 하나를 함유한 의약품을 말한다.
유전자치료제는 현재 치료법이 없는 희귀·유전 질환이나 기본 치료법에 대한 미충족 수요가 높은 퇴행성·난치성 질환에 대해 치료를 가능하게 할 것으로 기대되고 있다.
특히 근본적 치료를 가능케 하므로 질병 완치의 가능성 제공과 함께 높은 시장 잠재력을 보유하고 있어, 기존 바이오의약품 시장을 주도했던 2세대 항체 치료제를 넘어설 제약시장의 블루칩으로 부상하고 있다.
유전자치료제의 전달 수단 중 발현율 및 지속성 면에서 매우 우수한 것으로 알려져 있는 바이러스성 유전자치료제는 면역반응에 의한 안전성이 문제점으로 지적되고 있다.
이와 달리 바이러스성 벡터 외에 비결합 상태의 핵산(Naked DNA) 또는 세포 침투 능력을 향상시키는 양이온성 지질 등과 함께 제조된 핵산 등을 비바이러스성 유전자치료제라고 하며, 바이러스성 유전자치료제에 비하여 생분해성, 낮은 독성, 비면역원성 등 장점이 있다.
이에 따라 제약 바이오업체들은 비바이러스성 유전자치료제 개발을 적극 나서고 있는 상황이다.
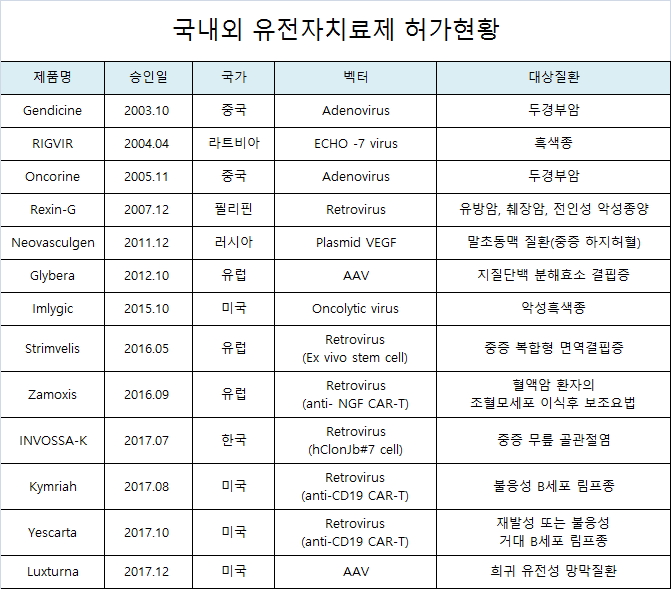
유전자치료제는 중국 바이오업체인 시비오노 젠테크(Sibiono Gentech)가 두경부암 치료제인 젠다이신(Gendicine)을 개발해 2003년 10월 중국식품약품감독관리국(SFDA)으로부터 최초의 유전자치료제로 허가를 받아 상용화됐다.
이후 2012년 7월 유럽연합(EU)은 선진국 최초로 유전자 치료제인 유니큐어(UniQure)의 '글리베라(Glybera)'를 허가했다.
2015년 미국식품의약국(FDA)은 항암 유전자치료제인 암젠(Amgen)의 ‘임리직(Imlygic)’을 허가했다.
이 후로 유전자치료제는 상당한 부가가치를 창출할 수 있는 차세대 첨단기술로서 인정받아, 선진국을 비롯해 전 세계적으로 활발하게 개발되고 있다.
우리나라도 2017년 7월 코오롱생명과학의 무릎 골관절염 치료제인 '인보사케이주가' 식품의약품안전처로부터 국내 첫 유전자치료제로 허가를 받았다.
코오롱생명과학이 첫 유전자치료제를 허가받은 이후 국내 제약 바이오업체들이 유전자치료제 개발 경쟁에 뛰어들고 있다.
국내 바이오업체중에는 바이로메드, 제넥신, 진원생명과학 등이 유전자치료제 개발 경쟁에서 앞서 나가고 있다는 평가를 받고 있다.
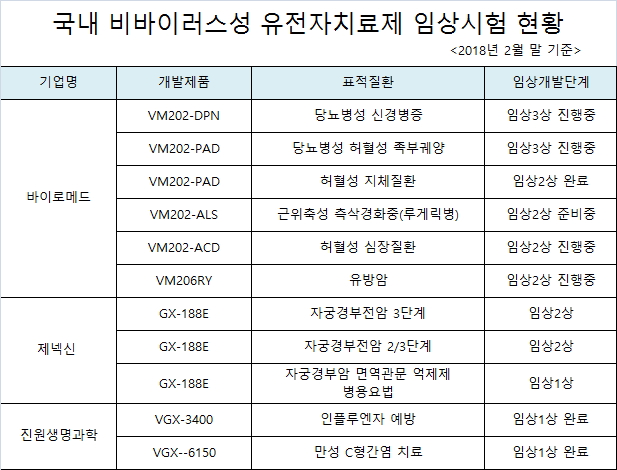
바이로메드는 당뇨병성 신경병증 치료제와 당뇨병성 허혈성 족부궤양 치료제에 대해 임상 3상을 진행하는 등 총 6개의 유전자치료제에 대한 임상 파이프라인을 보유하고 있다.
제넥신도 개발중인 자궁경부전암 치료제를 대상으로 임상 2상을 진행하는 등 총 3건의 유전자치료제에 대해 임상시험을 실시하고 있다.
진원생명과학도 인플루엔자 예방, 만성 C형간염 치료제 2개 제품에 대해 임상 1상을 완료한 것으로 나타났다.
이들 업체들외에도 녹십자, 대웅제약, 이연제약, 신라젠 등이 유전자치료제를 개발하고 있는 것으로 알려져, 국내 제약바이오업체들의 유전자치료제 해외임상 승인, 기술수출, 제품화 등 연구성과가 곧 가시화될 것이 기대되고 있는 상황이다.
|
|
-
01 알피바이오, NMN 기반 국내 첫 젤리스틱 프... -
02 아리바이오, 'AR100'1 중국 푸싱제약 독점판... -
03 비보존제약, 한국다이이찌산쿄와 비마약성 ... -
04 “상장 바이오헬스기업 반기 성장성 전년동... -
05 원텍, 과천 막계동 통합 신사옥 건립 추진 .... -
06 미국 FDA, 화장품 부작용 실시간 보고 대시... -
07 PhRMA “아동을 다시 건강하게? 백신접종부터..” -
08 [히트상품톺아보기] ㉘ 글로벌서 먼저 뜬 티... -
09 대한약사회, 한약사 불법조제·교차고용 고발... -
10 AZ, 영국 2억 파운드 확장 ‘보류’…빅파마 탈...











