뉴스
식약처, 생명 위협 ‘의약품 이상사례’ 200건 이상 놓쳐
감사원, 검토 업무 미흡 지적…재심사 시 이상사례 보고자료 활용 제기
박선혜 기자 │ loveloveslee@yakup.com


입력 2020-08-19 16:40 수정 2020.08.20 06:46
‘생명에 위협을 주는’ 중대한 이상사례에도 불구, 200건 이상 적정하게 보고하지 않은 것으로 드러났다.

|
여기서 ‘중대한 이상사례’는 이상사례 중 환자의 생명에 치명적이거나 위협적인 경우로 사망, 생명을 위협하는 사례, 입원 또는 입원기간 연장, 불구, 기형 등을 초래하는 경우를 말한다.
‘중대한 약물이상반응은’ 중대한 이상사례 중 의약품과 인과관계를 배제할 수 없는 경우로 인지한 날부터 15일 이내에 안전관리원장에게 보고하지 않으면 업무정지 등의 행정처분 대상이 된다.
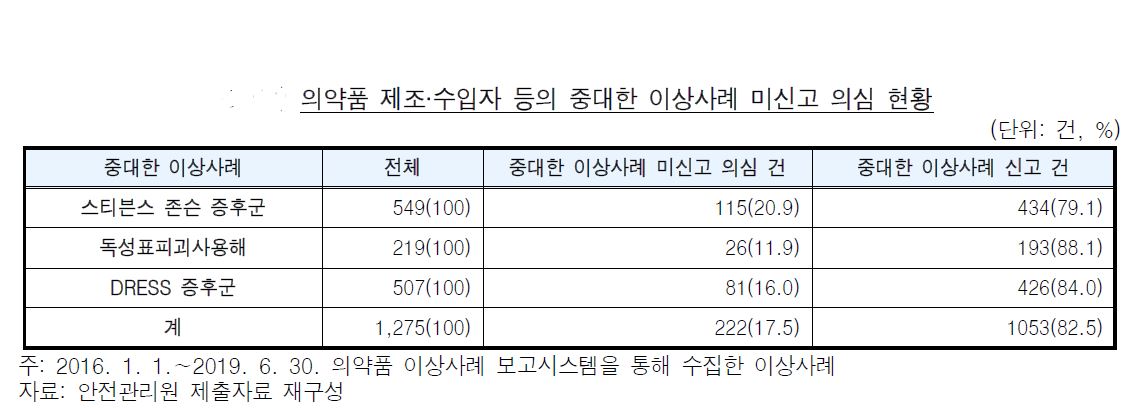
|
감사원에 따르면 2016년 1월 1일∼2019년 6월 30일 동안 중대한 이상사례에 해당하는 스티븐스 존슨 증후군125), 독성표피괴사용해, DRESS 증후군을 중대한 이상 사례로 분류하여 적정하게 보고하고 있는지 점검한 결과, 같이 전체 1,275건 중 222건을 중대한 이상사례가 아닌 이상사례로 신고하고 있었다.
또한 의약품 제조·수입자 등이 특정 의약품 사용 후 ‘사망’한 사례를 ‘중대한 이상사례’로 적정하게 보고하고 있는지 점검한 결과, 17건을 ‘이상사례’로 잘못 신고한 것으로 확인됐다.
더불어 15일 이상 지연 보고된 중대한 이상사례 보고 건 중 의약품과의 인과관계를 배제할 수 없는 중대이상반응 건의 보고 일을 점검해 본 결과, 중대한 약물이상반응 총 15,174건이 지연보고 한 것으로 나타났지만 점검 및 확인 또는 행정처분하지 않고 그대로 두고 있었다.
감사원은 “식약처가 제약사가 사용자로부터 보고받은 이상사례는 의무적으로 제출하도록 해 재심사에 활용하고 있는 반면, 안전관리원이 사용자로부터 직접 수집한 이상사례는 2018년까지 활용하지 않았고 2019년에 들어서야 2개 의약품 성분과 관련된 일부 이상사례만 활용하고 있는 것으로 나타났다”고 꼬집었다.
이어 “식약처가 안전관리원이 사용자로부터 직접 수집한 이상사례의 제출 여부를 제약사의 재량에 맡기고 있어 제약사는 추가적인 조사·연구에 대한 부담으로 해당 자료를 수집·제출하지 않을 가능성이 있다”고 언급했다.
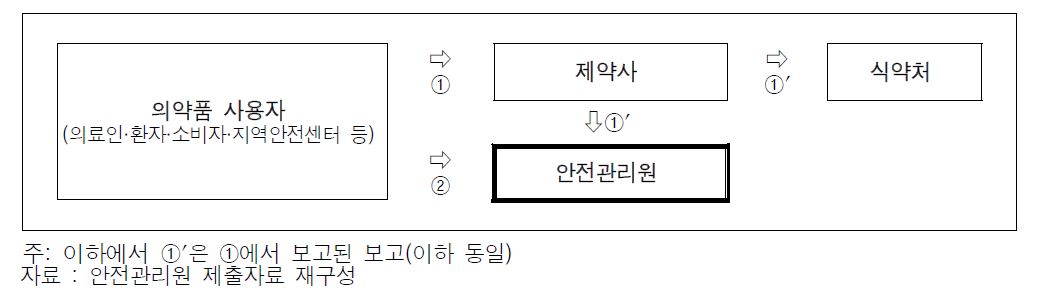
|
뿐만 아니라 재심사 시 식약처가 안전관리원에 대한 자료 제출 요구 권한을 제대로 사용하지 못하고 있다는 지적도 있다.
감사원에 따르면 2017년도 이후부터 2019년 상반기까지 재심사가 완료된 의약품에 대해 제약사가 제출한 시판 후 조사 결과 보고서와 안전관리원 이상사례 자료를 비교 분석한 결과 식약처는 재심사 시 사용자가 안전관리원에 보고한 이상사례를 제출받지 않아 새로운 이상사례가 발생했음에도 검토하지 못하고 있었다.
이에 감사원은 식약처는 의약품 재심사 시 의약품안전관리원에 수집된 자발적 이상사례 자료보고를 직접 제출받아 이상사례 평가 업무에 활용해야 한다고 제시했다.
식약처는 이견은 없다며 “향후 재심사 시 안전관리원에 수집된 이상사례를 포함하여 의약품의 시판 후 이상사례를 종합적으로 검토할 수 있도록 안전관리원과 협의를 거쳐 재심사 절차 개선방안을 마련하겠다”고 전했다.
전체댓글 0개
등록된 댓글이 없습니다.
오늘의 헤드라인
-
01 민텔 최고 혁신상, 2026년 수상작 공모 시작 -
02 엑셀세라퓨틱스, 中블루메이지와 ‘NK세포 배... -
03 '2025 KDDF CPG' 심포지엄 개막 "공동개발·... -
04 [일문일답] 셀트리온 서정진 회장 "트럼프발... -
05 약국 환자안전사고 84.9% ‘처방오류’…약사 ... -
06 식약처, 가르시니아 제품 회수 및 주의사항 ... -
07 인트론바이오, 항암면역 전문가 영입.. 항암... -
08 셀트리온,릴리와 미국 공장 인수 본계약 체... -
09 코스맥스, 한국 최초 IFSCC 본상 수상…글로... -
10 지오영, 의약품 유통업계 최초 SBTi 온실가...











