뉴스
[DI+의약정보] 큐리진 "혁신적 이중표적 shRNA·RNAi 전달기술 기반 '유전자 신약' 개발"
Bispecific shRNA 탑재 유전자치료제 CA102 임상 1상 가시화
권혁진 기자 │ hjkwon@yakup.com


입력 2022-04-06 06:00 수정 2023.01.26 14:48

|
mRNA 기반 코로나19 예방 백신이 성공을 이루며 RNA에 관심이 그 어느 때 보다 뜨겁다. 미국 대표 리서치 서비스 기관인 프로스트앤설리번에 따르면 RNA 치료제 관련 투자와 프로젝트는 지난 2015년 약 2,000건에서 2020년 약 4,500건으로 두 배를 넘어섰다. 시장 규모도 가파르게 증가해 지난해 4,938백만달러(약 6조원) 규모로 추산됐다. 또 연평균 17.6% 성장률로 2030년에는 25,122백만달러(약 30조원)에 도달할 것으로 전망했다.
이러한 트렌드에 따라 유망 RNA 기반 신약개발 기업에 대규모 투자가 이뤄지고 있다. 지난해 5월 큐리진은 115억원 규모의 투자를 유치했다. 해당 투자에는 LB인베스트먼트, 우신벤처투자, 하나금융투자 등에서 참여했다. 큐리진은 현재까지 약 185억원 누적 투자금을 확보, 혁신적인 기술 및 플랫폼을 기반으로 난치성 질환 치료제 개발에 매진하겠다는 입장이다.
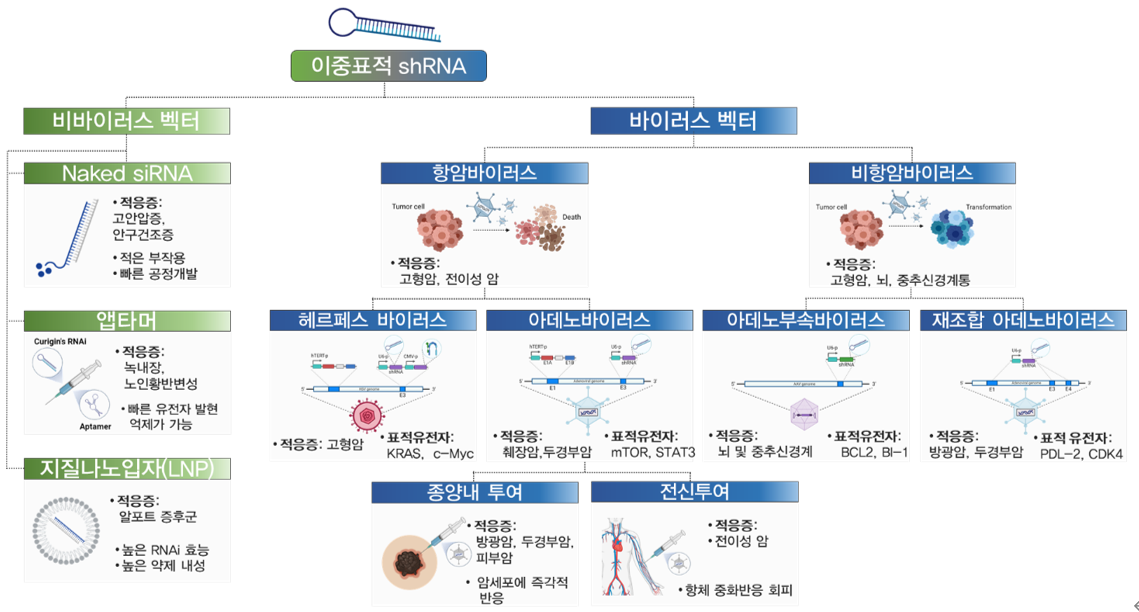
|
▲큐리진 파이프라인 이미지(출처: 큐리진)
큐리진은 RNAi 기술과 유전자 재조합 바이러스를 사용해 항암제 및 난치성 질환에 대한 유전자치료제를 개발하고 있다. 큐리진의 핵심 RNAi 기술은 질병의 원인이 되는 유전자의 타깃 mRNA에 결합해 발현을 원천 차단함으로써, 질병을 근본적으로 치료할 수 있을 것으로 주목받고 있다.
또한 자체 빅데이터 분석을 통해 2개 이상의 유전자를 동시에 타깃하는 '멀티 타깃 알고리즘' 기술을 기반으로 기존 RNAi 기술보다 더 높은 치료 효과를 나타내는 기술을 개발하고 있다. 특히 기존의 RNAi 치료제의 단점인 오프타깃과 단일 표적의 한계를 극복한 것으로 평가받고 있으며, 독자적인 바이러스 셔틀을 다수 확보함으로써, 기존 RNAi 치료제들이 가진 고질적 문제인 낮은 전달효율도 극복한 것으로 알려졌다.
이러한 플랫폼 기술은 각 특정 유전자와 질환에 쉽게 활용할 수 있으므로 적응증 확대에 유용하며, 큐리진은 우선 췌장암 등 난치성 암에 적용 후, 퇴행성 질환, 대사성 질환 등으로 파이프라인을 확장해 나갈 계획을 밝혔다.
‘Bispecific shRNA(이중표적 shRNA) 기술’
큐리진의 독자적인 Bispecific shRNA(이중표적 shRNA) 기술은 질병 관련 유전자를 두 개 이상 억제해 뛰어난 치료 효능을 나타낼 것으로 주목받고 있다. 특히 ▲오프타깃(Off-target) 부작용 제거 ▲이중 표적을 통한 두 개의 mRNA 동시 억제 ▲siRNA/shRNA와 RISC의 균등한 결합률로 표적 서열 동시 저해의 기술 혁신성이 높게 평가되고 있다.
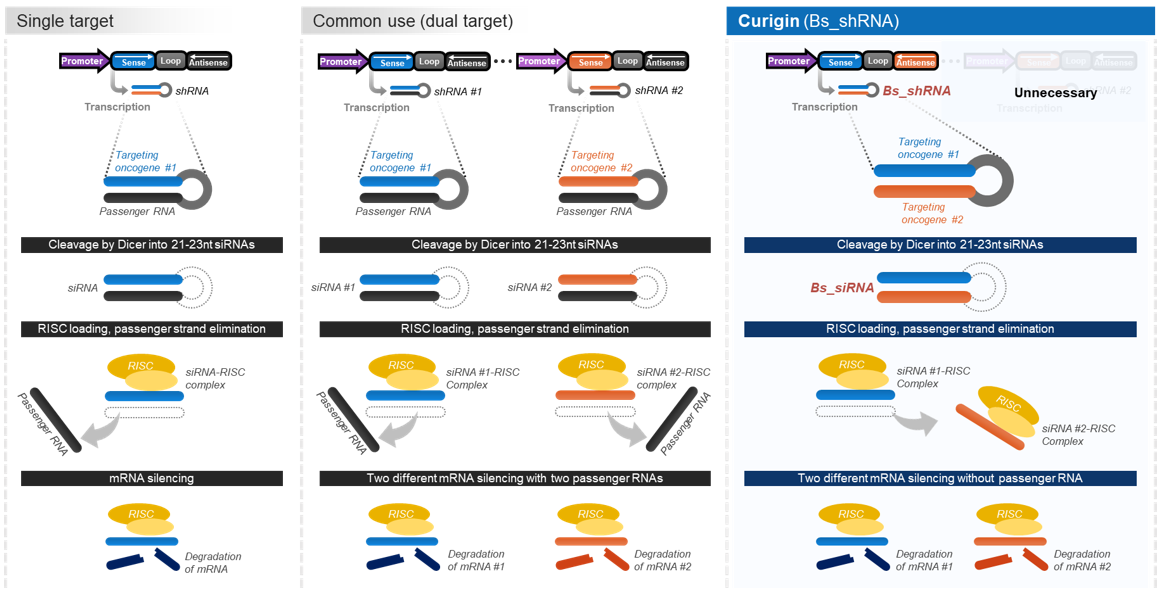
|
▲ Dual target shRNA vs Bispecific shRNA 이미지(출처: 큐리진)
큐리진에 따르면 기존 기술들은 표적 mRNA를 억제하는 guide strand와 이에 상보적인 passenger RNA에 의해 비표적 부위에서도 작용하는 부작용이 발생해 신약개발에 어려움이 있었다. 그러나 큐리진에서는 guide strand와 passenger strand 모두 표적 mRNA를 억제하는 서열로 구성해, 부작용 발생에서 보다 자유로운 장점이 있다.
또한 이중 표적을 통한 두 개의 mRNA 동시 억제가 가능하다. 큐리진에서는 한 카세트 내에 이중표적 유전자 서열을 삽입해, 동일한 promoter에 의해 shRNA가 전사되도록 했다. 즉, 두 개의 siRNA가 일렬의 전사과정으로 생성돼, 두 siRNA 생성 비율이 균등하다.
아울러 기존 siRNA/shRNA는 상보적 서열 중 하나의 서열이 우세하게 RISC와 결합해 표적 유전자를 90% 이상 저해하는 데 반해, 큐리진의 siRNA/shRNA는 내부 알고리즘에 의해 두 상보적 서열에서 모두 RISC와 균등한 결합률을 갖도록 디자인했다. 이에 따라 표적 유전자의 mRNA 발현을 균일하게 감소시킨다.
‘RNAi Delivery System(RNAi 전달 시스템)’
큐리진은 질환 특성에 따라 Viral 또는 Non-viral 전달 방식을 선택해 bispecific shRNA를 안정적으로 운반할 수 있는 기술을 확보해 연구·개발하고 있다.
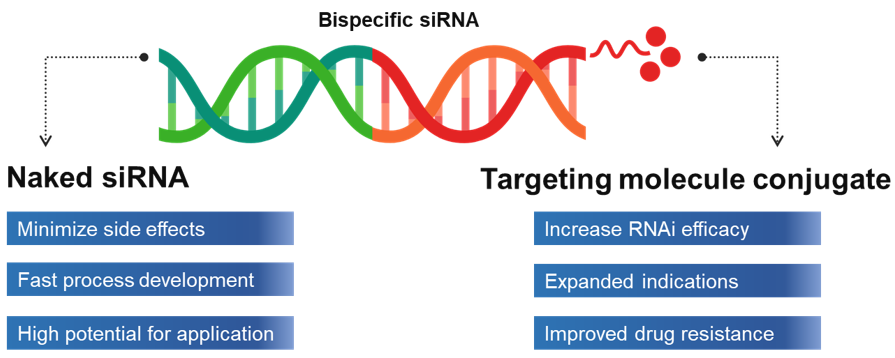
|
▲Non-viral delivery 이미지(출처: 큐리진)
큐리진에 따르면 Non-viral delivery는 질환 특성에 맞게 다양한 기술을 접목해 siRNA 작용 효율을 높이는 기술이다. 큐리진에서는 안정적이고 효율적으로 질병 관련 유전자를 저해하기 위해 siRNA의 Chemical modification을 연구 중이다.
2′-O-methyl (2′-OMe), 2′-methoxyethyl (2′- MOE), Phosphorothioate를 이용한 siRNA modification은 Naked siRNA가 Bispecific shRNA의 염기서열을 화학적으로 변형시켜 Naked Bispecific shRNA 자체가 생체 내에서 안정성을 유지할 수 있도록 한다.
특히 면역세포와 같이 특정 세포의 막단백질과 결합할 수 있는 Targeting molecule의 활용을 통해 여러 적응증을 표적할 수 있다. Targeting molecule 중 현재 개발하고 있는 Aptamer와 Bispecific shRNA 결합을 활용한 기술은 특정 세포의 막단백질과 직접 결합함으로써 체내 안정성과 표적 유전자의 저해뿐만 아니라 경쟁적 억제제 효능을 나타낸다.
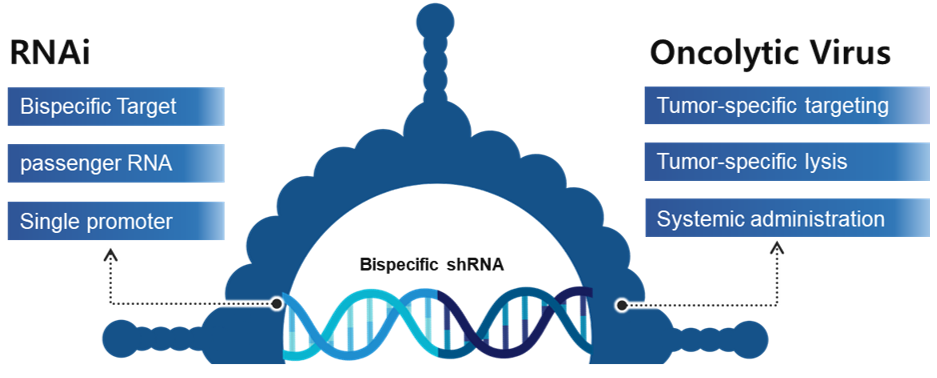
|
▲Viral delivery 이미지(출처: 큐리진)
Viral delivery는 Bispecific shRNA를 표적하는 종양까지 안정적으로 운반하기 위한 기술이다. 큐리진에서는 표적 유전자 서열을 암세포 특이적 복제가 가능하도록 개조된 Viral vector에 삽입함으로써 전달 효율을 높였다.
Viral delivery로 통상 재조합 아데노바이러스를 사용하며, 아데노바이러스는 체내 안전성이 매우 우수하고, 생산 효율이 mL당 1012으로 높다는 장점이 있다. 이에 따라 생산 단가 절감을 통한 RNAi 치료제의 고비용 문제를 해결할 수 있다. 특히 큐리진의 재조합 아데노바이러스는 정맥 투여에도 체내 면역 작용에 의해 분해되지 않아 안정적으로 종양 특이적 전달이 가능하다.
‘큐리진 유망 파이프라인 CA102’
CA102는 암 특이적 운반체로 개조한 아데노 바이러스에 큐리진의 고유 기술로 제작된 Bispecific shRNA를 탑재한 유전자치료제다. 현재 CA102는 취장암, 방광암, 두경부암을 적응증으로 연구·개발 중이며, 임상시험 진입을 목전에 두고 있다.
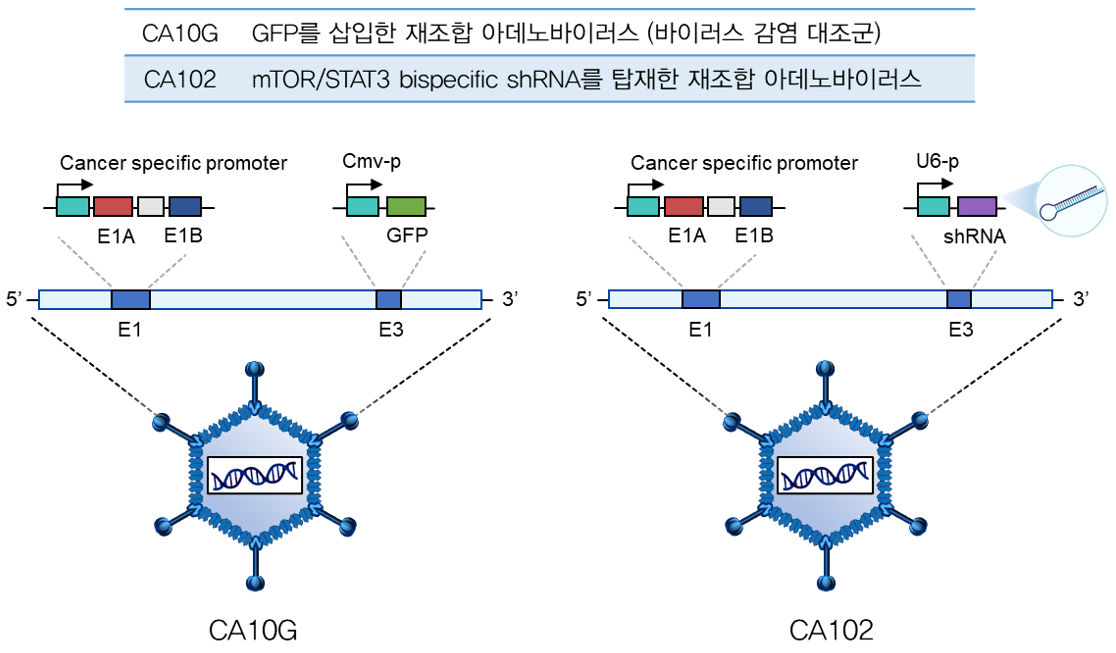
|
▲큐리진 유전자치료제 CA102 (출처: 큐리진)
큐리진에 따르면 CA102는 암세포만 감염시키고 암 생존 및 전이에 중요한 유전자인 mTOR와 STAT3를 동시에 억제한다. 특히 CA102가 암세포와 높은 결합력을 가질 수 있도록 바이러스의 knob 부분을 개조했다. 개조한 knob 부분은 다양한 암에서 과발현되는 DSG2(Desmoglein 2) 수용체에 결합해 더욱 강한 암세포 특이적 결합력을 가진다. 또한 암 특이적 전사인자에 의해 활성화되는 인간 텔로머레이즈 역전사 프로모터(hTERT)를 통해 암세포에서 복제된다.
‘CA102 항종양 효능시험’
큐리진은 CA102의 항종양 효능을 확인하기 위해 동물실험을 진행한 결과, 대조군 대비 종양 크기 감소 및 종양 사멸이 관찰됐다고 밝혔다.
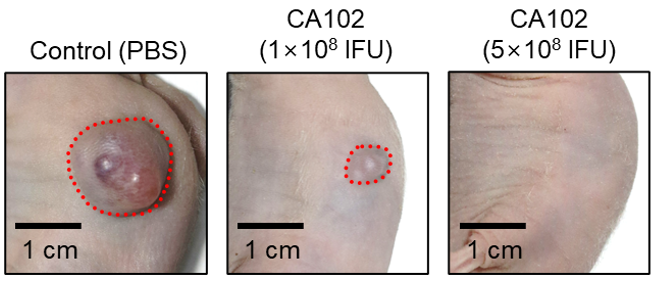
|
▲방광암에 대한 항종양 효능시험(출처: 큐리진)
큐리진에 따르면 Bladder cancer cell(방광암 세포)인 253J-BV를 Balb/c Nude mouse에 피하주사해 종양 모델을 구축하고, 종양 크기가 그룹마다 평균 ~200 ㎣가 되는 시점부터 CA102를 종양 내 직접 투여한 후, 주 2회 이상 Caliper를 사용해 종양 크기를 측정하고 변화를 관찰했다.
PBS를 투여한 대조군을 기준으로 비교했을 때, CA102를 1×10^8 IFU로 1일 1회, 총 5회(투여 총 농도=5×10^8 IFU) 투여한 그룹에서 종양이 완전히 사라지는 것이 확인됐다. 또한 CA102를 1×10^8 IFU로 1회 투여한 그룹에서도 대조군 대비 종양 크기가 약 80% 이상 줄어든 것이 확인됐다. 이에 따라 CA102는 1회 투여만으로도 항종양 효과가 매우 뛰어나며, 투여 횟수 5회 만에 종양을 완전히 사멸할 수 있는 것으로 나타났다.
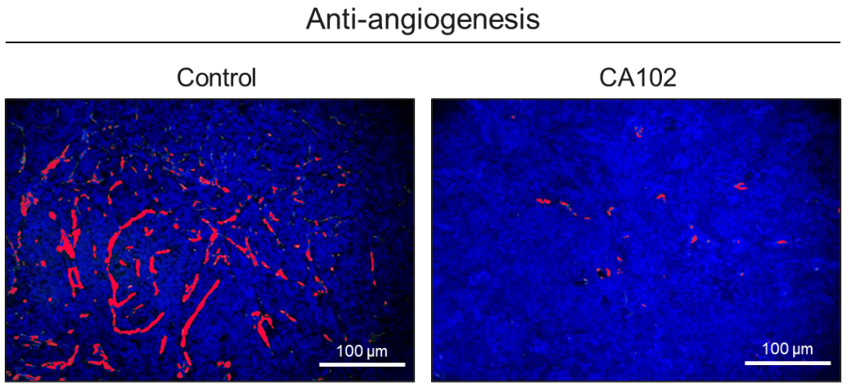
|
▲방광암에 대한 혈관신생 억제 효능시험(출처: 큐리진)
또한 추가로 대조군과 CA102가 투여된 그룹의 종양 조직을 채취해 IF(immunoflourecence) 실험으로 혈관 신생 능력 변화를 분석했다. PBS만 처리한 대조군을 기준으로 CA102 투여 그룹의 CD31 발현을 비교한 결과, CA102 투여군에서 혈관 신생 작용이 약 90% 이상 억제된 것으로 나타났다.
이는 CA102에 삽입된 Bispecific shRNA가 혈관 신생에 밀접하게 관여하는 유전자인 mTOR, STAT3를 억제함으로써 항-혈관 신생 효능이 나타난 것으로 판단된다. 최종적으로 CA102는 Bispecific shRNA를 통한 유전자 수준의 치료와 항암 바이러스에 의한 직접적인 종양 용해성 작용을 통해 높은 항종양 효과를 나타내는 것이 증명됐다.
이는 CA102에 삽입된 Bispecific shRNA가 혈관 신생에 밀접하게 관여하는 유전자인 mTOR, STAT3를 억제함으로써 항-혈관 신생 효능이 나타난 것으로 판단된다. 최종적으로 CA102는 Bispecific shRNA를 통한 유전자 수준의 치료와 항암 바이러스에 의한 직접적인 종양 용해성 작용을 통해 높은 항종양 효과를 나타내는 것이 증명됐다.
[관련기사]
mRNA 백신 성공, 기대되는 'RNA 신약'…차세대 최강자는?
2022-02-15 06:00
전체댓글 0개
등록된 댓글이 없습니다.
오늘의 헤드라인
-
01 "확장과 변화, 경계를 넘어" 제20회 경기약... -
02 차바이오텍 CGT 날개 단다㊦ 엑소좀으로 난... -
03 차바이오텍 CGT 날개 단다㊤ 아이디어 하나... -
04 건강기능식품은 내수 전용, 인식 벗을까? -
05 휴온스그룹, 창립 60주년…글로벌 헬스케어 ... -
06 프로젠, 유럽 당뇨병학회서 'PG-102' 연구성... -
07 미국 FDA, 의약품 '보안요구서한'(CRL) 202... -
08 뉴로핏 "10년간 뇌질환 영상 진단만 팠다…26... -
09 옵디보·여보이, 간세포암 1차 치료 대한 적... -
10 “살아남을 시간이 없다”… 빌로이, 전이성 위...











