뉴스
대세는 유전자치료제…'AAV 벡터' 무한 가능성②
아데노부속바이러스 벡터, 혈우병A·근이영양증 등 유전자치료제로 개발 중
권혁진 기자 │ hjkwon@yakup.com


입력 2022-07-20 06:00 수정 2022.07.20 15:40
유전자치료제 승인과 개발에 성과가 나타나며, 유전자의 전달체인 바이러스 벡터도 함께 주목받고 있다. 특히 최근 아데노부속바이러스(AAV) 벡터의 활용성과 기능성이 높게 평가되며 기대를 받고 있다.
지난 6월 BIO USA 2022(Bio International Convention)에서 Biotech Primer의 케빈 커랜(Kevin Curran) 박사가 글로벌 유전자치료제 개발 현황과 바이러스 벡터의 가능성을 제시했다. 바이러스 벡터(Viral vector)는 유전물질을 생체 내로 전달하기 위한 바이러스 기반 전달체다.
지난 6월 BIO USA 2022(Bio International Convention)에서 Biotech Primer의 케빈 커랜(Kevin Curran) 박사가 글로벌 유전자치료제 개발 현황과 바이러스 벡터의 가능성을 제시했다. 바이러스 벡터(Viral vector)는 유전물질을 생체 내로 전달하기 위한 바이러스 기반 전달체다.
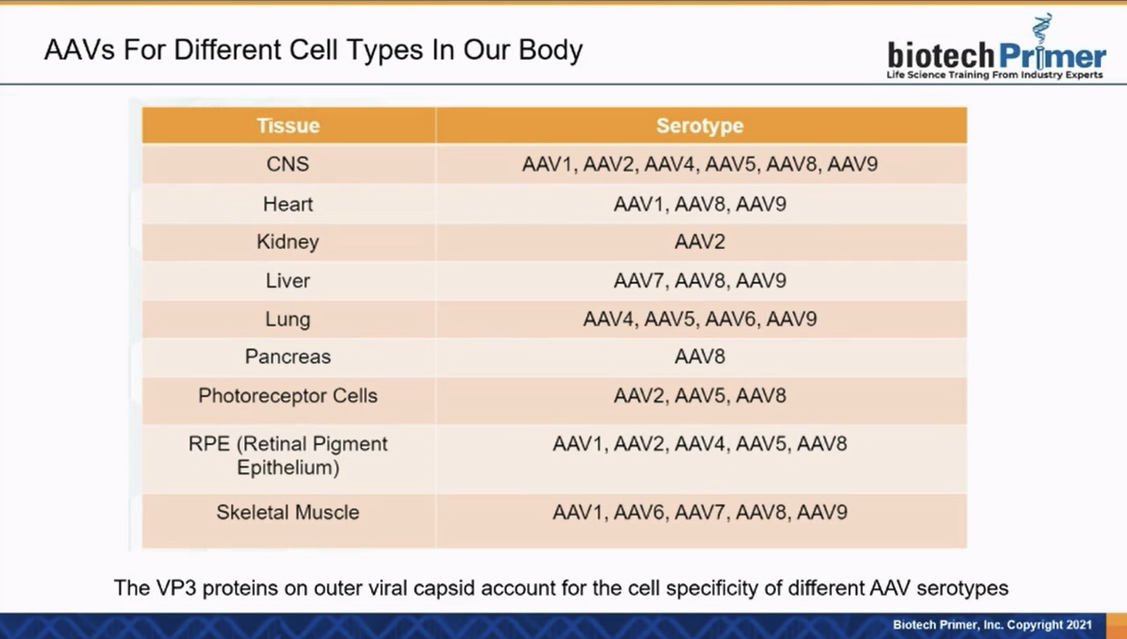
|
▲AAVs 출처:BIO USA 2022 Biotech Primer의 케빈 커랜(Kevin Curran) 박사 발표자료
약물의 투여는 유전자치료제 개발하는 기업에게 큰 전략 중 하나로 여겨지고 있다. 표적하는 세포와 전달시스템의 특이성에 따라 신약개발 가능성이 예측되고 기업의 가치가 결정되기 때문이다. 현재 유전자치료제 전달체로는 아데노바이러스(Adenovirus)가 가장 많이 사용되고 있고, 이어 렌티바이러스(Lentivirus), 플라스미드 DNA(Plasmid), 아데노부속바이러스(Adeno-associated virus) 등이 사용되고 있다.
특히 AAV 바이러스 벡터는 다른 바이러스 벡터에 비해 면역 문제가 매우 낮은 특징이 있다. 또 분열 세포와 비분열 세포를 모두 표적으로 삼는다. 이에 따라 기존 벡터와 달리 형질주입(Transfection)이 어려운 중추신경계와 근육, 안구 등을 타깃으로 한 유전자치료제로 개발되고 있다.
케빈 커랜 박사는 “바이러스 벡터는 간과 신장 등, 특정 신체 부위에서 기인하는 유전적 질환의 치료를 혈류로서 특정 세포를 표적하게 해, 치료를 가능하게 한다. 이는 바이러스의 특성을 이용해 치료적 유전물질을 전파하는 것“이라며 “현재 AAV를 기반으로 바이오마린(BioMarin)에서 간세포를 표적하는 혈우병A 치료제(Roctavian) FDA 승인을 진행 중”이라고 설명했다.
이어 “이 약물은 혈우병A 환자들에게 없는 혈액응고인자 VIII(8) 효소를 AAV 벡터를 사용해 간세포에 삽입한다”라며 “실제 환자에게 투여 시, 응고인자 VIII가 기준선 이상으로 증가하는 것이 확인됐다”고 덧붙였다.
이 외에도 AAV 전달체 기반의 승인된 유전자치료제는 노바티스의 Zolgensma(졸겐스마), Luxturna(럭스터나)가 있다. 최근에는 Pfizer, Sarepta, Genethon, Solid Biosciences 등이 AAV를 기반으로 한 뒤센형(Duchenne) 근이영양증(DMD) 치료제 개발을 진행 중이다.

|
▲Promoter 출처:BIO USA 2022 Biotech Primer의 케빈 커랜(Kevin Curran) 박사 발표자료
또한 케빈 커렌 박사는 유전자의 발현을 조절하는 프로모터(Promoter)의 중요성도 강조했다. 그는 “세포 표면에 바이러스가 고정되고, 치료 유전자가 세포 안으로 내재화됐을 때, 실제 유전적 발현이 잘 일어나는지, 충분한 수준의 치료 단백질을 번역할 수 있는지가 핵심”이라고 전했다.
이어 “코로나19 바이러스 감염과 백신 접종과 같이, AAV 바이러스 벡터로 치료를 받으면 신체가 이에 대한 면역기억을 생성할 기회를 갖게 된다”라며 “향후 Promoter의 연구 방향은 일회성이 아닌, 평생 충분한 수준의 치료 단백질을 지속해서 번역하는지를 목표로 해야한다”고 덧붙였다.
아울러 “AAV는 약 4,000개 염기쌍의 DNA만 포장이 가능해, 용량의 제약이 있다”라며 “거대한 유전자를 AAV에 맞추기 위한 자체 전략도 마련해야 한다”고 부연했다.
[관련기사]
대세는 유전자치료제…'바이러스 벡터' 주목①
2022-07-19 06:00
FDA 승인 신약 66% '소규모 바이오텍'서 시작…"韓 가능성 있어"
2022-06-28 06:00
"美 지난해 '전임상 단계' 신약후보로 바이오텍 25곳 나스닥 상장"
2022-06-27 06:00
전체댓글 0개
등록된 댓글이 없습니다.
오늘의 헤드라인
-
01 "회원 중심 약사회" 강남구약, 한약사·기형... -
02 오가노이드사이언스-아론티어, 오가노이드·A... -
03 중기중앙회,약가인하 당면 제약계 부정적 영... -
04 차바이오텍, 한화생명·한화손보에 1천억 전... -
05 “아이 건강 최우선 가치로”…한미약품, 유소... -
06 앱클론,“AC101,임상3상 이미 40%" ...JPM서... -
07 현대바이오, 서울대병원과 '전립선암 가짜내... -
08 로킷헬스케어, “4주 완전 발모” 역노화 기술... -
09 애드바이오텍, H9N2 저병원성 조류인플루엔... -
10 알테오젠,2030년까지 9개 이상 품목 상업화-...











