뉴스
브릿지바이오, 신약개발 성공의 첫 걸음 '유기적 임상시험 전략'
최근 마케팅 측면이 임상시험 개발 주도…허가전략·매출·시판 시기 등 유기적 협력 필수
권혁진 기자 │ hjkwon@yakup.com


입력 2021-09-06 06:00 수정 2021.09.06 12:09
신약개발을 가장 활발히 하는 기업 중 하나로 알려진 브릿지바이오테라퓨틱스가 NIFDS-DIA 워크숍에서 신약개발의 성공을 위한 임상시험 전략의 중요성을 발표해 주목받았다.
|
지난 3일 식품의약품안전평가원(NIFDS)과 미국약물정보학회(DIA)가 공동으로 `코로나19 백신, 치료제 규제 및 개발 촉진·신약개발과 규제 동향(Facilitating the Development and Regulations of COVID-19 Vaccines and Treatments·Current Trends in New Drug Development and Regulations)` 워크숍 2일 차를 온·오프라인으로 진행했다.
이번 워크숍에서는 브릿지바이오테라퓨틱스의 염선영 임상 전략 담당 부사장 (정신과 전문의)가 `Clinical Development Strategy` 주제로 다년간 쌓아온 임상시험 진입·연구개발에 관한 전략을 발표했다.
브릿지바이오테라퓨틱스는 혁신 신약 연구개발 기업으로 특발성 폐섬유증치료제 후보물질 BBT-877, 궤양성 대장염치료제 후보물질 BBT-401, 차세대 폐암 표적항암제 후보물질 BBT-176 등 다양한 신약후보물질 파이프라인을 보유하고 있다.
|
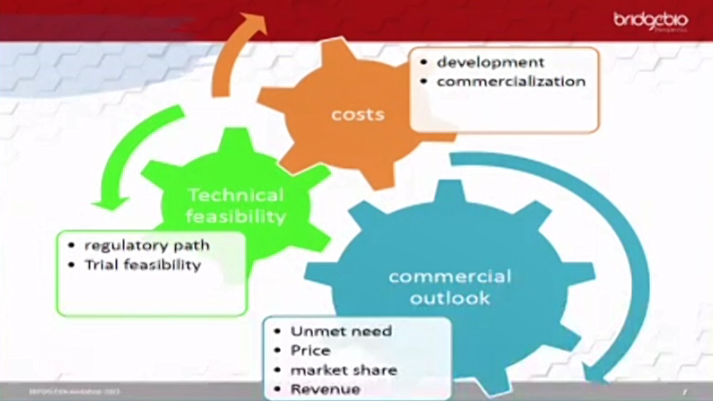
신약개발의 경우 장기간이 소요되고, 완료 시점을 특정하기가 어려우므로 개발 중에 주기적으로 수요 분석 및 예측을 통해 미충족 수요를 찾는 것이 중요하다고 덧붙였다.
또한 염선영 부사장은 신약의 허가전략도 임상개발 전략에 영향을 미치는 핵심 요소라며 신약을 허가받을 때 국가별 규제기관이 요구하는 필수 제출 데이터가 다르므로 이를 분석해 임상 프로토콜 작성과 임상 전략을 설정하는 것이 필요하다고 강조했다.
염 부사장은 “예를 들어 근골격계 통증 약을 허가받으려면 유럽은 요통을 제외한 두 개의 근골격계질환에서 두 개의 임상시험에서 약효를 증명해야 하고, 미국은 요통을 포함할 수 있는 두 개의 근골격계질환에서 세 개의 임상시험을 진행해야 한다”라며 “각국의 규제기관의 요구조건이 다르므로 타깃으로 하는 규제기관의 요구사항을 자세히 살펴야 한다”라고 전했다.
|
염선영 부사장은 개발하는 의약품의 수익적인 부분도 고려해야 할 사항으로 들었다.
염선영 부사장에 따르면 신약의 수익 구조의 큰 영향을 미치는 약가는 국가별로 약가를 책정하는 기준이 다르고, 다른 국가에서 책정된 약가를 참조해 해당 국가에서 약가가 책정되므로 기업 목표와 부합하는 약가전략을 설정해야 한다.
염선영 부사장에 따르면 신약의 수익 구조의 큰 영향을 미치는 약가는 국가별로 약가를 책정하는 기준이 다르고, 다른 국가에서 책정된 약가를 참조해 해당 국가에서 약가가 책정되므로 기업 목표와 부합하는 약가전략을 설정해야 한다.
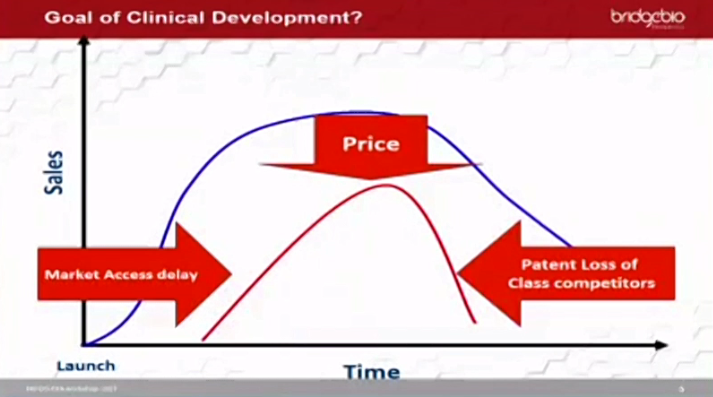
또한 임상시험 지연, 시판 시점 지연, 경쟁제품과의 시판 순서에 따라서도 수익적인 부분이 크게 차이가 날 수 있다. 이런 요소가 고려돼 타임라인이 조정되고 임상시험 디자인도 조정된다.
특히 같은 계열 약물의 특허 만료 시기와 같은 질환을 치료하는 다른 계열 약물의 특허 만료 시기에 따른 제네릭 출시로 기대 매출이 급감하는 경우가 있다며, 변화하는 시장을 계속 예측하고 이 예측치를 수정해야 한다.

|
그는 “규제기관에 임상시험 자료를 제출할 때 기업에 유리한 자료만을 선택적으로 취합할 수 있는 것이 아니기 때문에 시험 프로토콜 작성을 신중히 해야 한다”고 발표했다.
또한 “우수한 임상시험 자료와 연구를 위해 너무 장시간을 소모하면 특허에 대한 메리트가 사라지기 때문에 기간도 고려해야 할 요소”라고 전했다.
이어 그는 “신약개발 임상시험은 안전성으로 시작하는 것이 아니라, 리스크를 중점으로 이에 대한 환자를 특정화하고 이 리스크를 최소화하는 것을 목표로 설정하는 것”이라며 “전임상에서 시험 결과가 비슷한데 임상에서 성공하는 물질과 그렇지 못한 물질에 차이에서 앞서간 같은 클래스 약물의 실패 원인을 꼼꼼하게 분석하고, 해결 전략을 설정하는 것이 임상시험을 성공으로 이끄는 좋은 전략”이라고 밝혔다.
전체댓글 0개
등록된 댓글이 없습니다.
오늘의 헤드라인
-
01 한국콜마, 세계적 화학기업 '바스프' 손잡... -
02 '2000억원' 규모 26년 국가신약개발사업 스... -
03 대한약사회, 건보공단 특사경 도입 '찬성'…... -
04 대한약사회, 대웅제약에 '블록형 거점도매 ... -
05 한올바이오, 오송 특화공장 신축 투자 중단 -
06 한국유니온제약,M&A 공고...'스토킹호스' 방... -
07 IVI-질병관리청, 팬데믹 대응 임상시험검체... -
08 GC녹십자, 코로나19 mRNA 백신 국내 임상 1... -
09 마이크로디지탈, 셀트리온 생산공정에 ‘더... -
10 디앤디파마텍, “FDA의 AI 기반 MASH 조직 분...











