뉴스
중소 제약기업 70% '국가 간 상호인증' 희망
해외 인허가 애로사항 분석…매출·규모 낮을수록 허가취득·인허가 낮아
이승덕 기자 │ duck4775@yakup.com


입력 2019-06-17 06:00 수정 2019.06.17 06:00
매출·규모가 낮은 중소 기업일수록 해외 허가·인허가에 더욱 어려움을 느끼는 가운데, '국가 간 상호인증'이 가장 갈증을 느끼는 정책지원인 것으로 나왔다.

|
연구팀은 2019 Conention on Pharmaceutical Ingredients(CPhI)에 참가는 국내 제약사 중 걸프협력회의(GHC), 남아프리카개발공동체(SADC), 세계보건기구(WHO), 터키, 인도, 이란을 대상으로 의약품 해외 인허가 경험이 있는 60개 제약사를 대상으로 진행했다(응답사 28곳, 응답률 46.7%).
이를 바탕으로 매출규모를 나눠 비교분석 및 빈도분석, 평균분석, 비모수 t-test 교차분석(유의수준 P<0.05)을 진행했다.
연구 결과, 지역별 허가신청 및 취득 결과가 아시아와 신흥국에서 높은 허가 성공률을 보였으며, 미국/유럽과 같은 선진국에서는 저조한 결과가 나왔다.
특히 1천억원 미만 기업이나 중소기업이 현저히 낮은 성공률을 보여 기업 매출·규모에 대해 유의미한 차이가 발생한 것을 확인했다.
이러한 양상은 기업 인허가 단계에서의 어려움 정도 차이에서도 확인됐다.
중소기업과 비중소기업으로 분류했을 때, IND(임상시험계획승인절차) 과정과 NDA(신약판매 승인신청) 과정 대부분에서 중소기업의 어려움이유의하게 높다는 결과를 나타냈다.
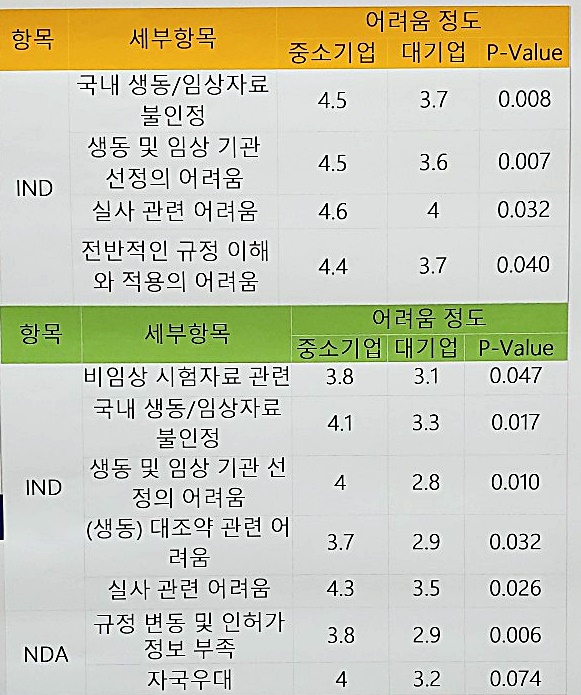
|
IND와 NDA 세부 항목을 보면, '비임상 시험자료 관련' 문항에서 중소기업(3.8)이 대기업(3.1)보다 어려움 정도가 높았고(P-Value 0.047), '국내 생동/임상자료 불인정'에서는 중소기업(4.1)이 대기업(3.3) 대비 어려움 정도가 높아(P-Value 0.017) 격차가 컸다.
더불어 '생동 및 임상기관 선정의 어려움'에서도 중소기업(4)과 대기업(2.8) 차이가 컸으며(P-Value 0.010), '규정 변동 및 인허가 정보부족'도 중소기업(3.8)이 대기업(2.9)보다 컸다.
특히 '해외 인허가 지원 방안'에서는 매출 규모 1000억원 미만 기업 중 70%, 중소기업 중 75%가 국가 간 상호인증에 대한 지원을 희망했다.
연구팀은 "해외 진출 시 국내 제약사의 비용 및 시간 절감을 위해 국내 임상시험관리기준을 구체화해 국내 임상 시험 실시기관과 생물학적동등성자료가 해외 기관에서 상호인증을 받도록 정부 부처가 협력해 정부간 G2G 방식을 통한 상호인정을 추진해야 한다"고 제언했다.
이어 "GMP 관리와 실사 수준을 상향조정해 KGMP가 국제사회에서 인정받는 것이 시급하다"면서 "GMP 관리 및 실사수준 제고를 위해 글로벌 수준에 맞는 GMP 관리·실사를 시행하고, 전문성 확보를 위한 인력 양성 정책 방안을 마련해야 한다"고 덧붙였다.
전체댓글 0개
등록된 댓글이 없습니다.
오늘의 헤드라인
-
01 네오이뮨텍, 유상증자 472억원 조달 성공…"... -
02 오토텍바이오, 퇴행성 타우 뇌질환 신약 ‘AT... -
03 부산시약사회, 의약품 토요 배송 휴무 실태... -
04 뉴라클제네틱스, 황반변성 신약 'NG101' 기... -
05 명인제약, CNS 경쟁력·펠렛 제형 앞세워 코... -
06 셀루메드, 피부이식재 '셀루덤 파워' 제조 ... -
07 뉴메코, 보툴리눔 톡신 제제 ‘뉴럭스’ 볼리... -
08 케어젠,필러 의료기기 인도 CDSCO 등록 완료 -
09 제이투에이치바이오텍, '케이캡' 결정형 분... -
10 동방에프티엘, ‘니르마트렐비르’ WHO PQ- WH...











