뉴스
혈액응고저지제 '헤파린' 주사제 18품목 허가사항 변경
식약처, 미국 FDA 안전성 정보 수용…신생아·미숙아 투여 금지 등 신설
김용주 기자 │ yjkim@yakup.com


입력 2019-01-17 06:20 수정 2019.01.17 09:40
|
식품의약품안전처는 '헤파린' 주사제의 미국 식품의약품청(FDA) 안전성 정보와 관련해 국내·외 허가 현황, 제출의견 등을 종합 검토한 결과에 따라 2월 1일자로 허가사항을 변경지시할 계획이라고 밝혔다.
우선 경고 사항에 '벤질알콜은 조숙아에게서 치명적인 가쁜 호흡증상과 연관이 있는 것으로 보고되었다'는 내용이 신설된다.
또 '신생아, 미숙아(벤질알콜을 함유하고 있다)' 환자에게는 투여하지 말아야 한다는 내용이 추가된다.
이상반응에 '헤파린 유도 혈소판감소증은 헤파린 투여 중단 수주 후에도 발생할 수 있다'는 내용이 반영된다.
일반적 주의에 '헤파린 유도 혈소판감소증은 헤파린 투여 중단 수주 후에도 발생할 수 있다'는 것과, 상호작용에 '니트로글리세린 중단에 따라 반동효과가 발생할 수 있다. 헤파린과 정맥용 니트로글리세린을 동시 투여하는 과정에서 부분트롬보플라스틴 시간에 대한 면밀한 모니터링과 헤파린 용량 조절이 권고된다'는 내용이 신설된다.
이와 함께 '이 약은 벤질알콜을 함유하고 있다. 벤질알콜은 태반을 통과할 수 있고, 모유로 이동할 수 있으므로 임부 및 수유부에게 투여를 주의한다'는 내용이 추가된다.
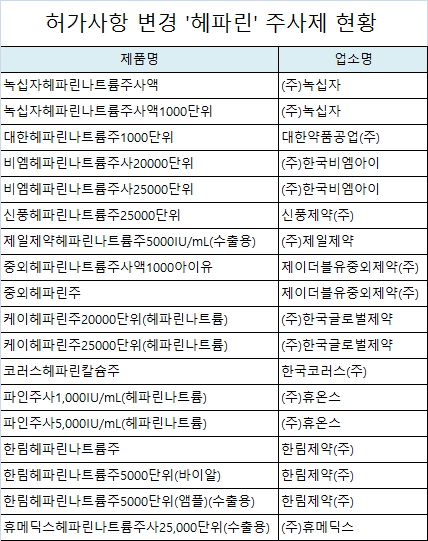
허가사항 변경되는 '헤파린' 주사제는 녹십자의 '녹십자헤파린나트륨주사액', JW중외제약의 '중외헤파린주' 등 18품목이다.
전체댓글 0개
등록된 댓글이 없습니다.
오늘의 헤드라인
-
01 네오이뮨텍, 유상증자 472억원 조달 성공…"... -
02 오토텍바이오, 퇴행성 타우 뇌질환 신약 ‘AT... -
03 부산시약사회, 의약품 토요 배송 휴무 실태... -
04 뉴라클제네틱스, 황반변성 신약 'NG101' 기... -
05 명인제약, CNS 경쟁력·펠렛 제형 앞세워 코... -
06 셀루메드, 피부이식재 '셀루덤 파워' 제조 ... -
07 뉴메코, 보툴리눔 톡신 제제 ‘뉴럭스’ 볼리... -
08 케어젠,필러 의료기기 인도 CDSCO 등록 완료 -
09 제이투에이치바이오텍, '케이캡' 결정형 분... -
10 동방에프티엘, ‘니르마트렐비르’ WHO PQ- WH...











