뉴스
국내 '융복합 의약품' 320개 사용중…프리필드시린지 95%
2013년 바이오약-의료기기 의뢰 절차로 허가품목 증가
이승덕 기자 │ duck4775@yakup.com


입력 2019-06-10 12:04 수정 2019.06.10 12:05
현재 국내에서 사용되는 융복합 의약품이 320개로, 그중 대부분은 프리필드시린지인 것으로 나타났다.
식품의약품안전처(처장 이의경, 이하 식약처)가 최근 발간한 '융복합 의료제품 개발을 위한 자료집'에서는 이 같은 내용을 확인할 수 있었다.
자료집에서는 '식약처 융복합혁신제품지원단 융복합기술정책팀' 출범 이전(2019년 2월 28일 기준)까지의 품목정보를 토대로 융복합 의료제품 허가 현황(취소·취하 품목 제외)을 확인했다.
|
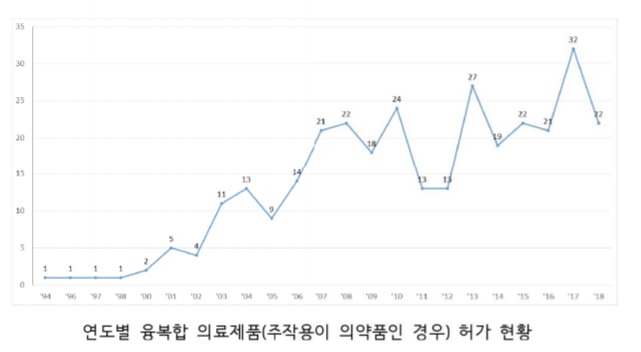
'주작용이 의약품인 융복합 의료제품'은 1994년부터 허가되기 시작했으며, 현재 총 320개 제품이 사용되고 있다.
이들 제품은 첫 허가 이후 연도별로 꾸준한 증가세를 보이고 있으며, 2013년부터 본격적으로 바이오의약품-의료기기 간 협의의뢰 절차(공무원 지침서)가 제정·운영되면서 연간 20개 품목 이상으로 꾸준히 증가됐다.
|
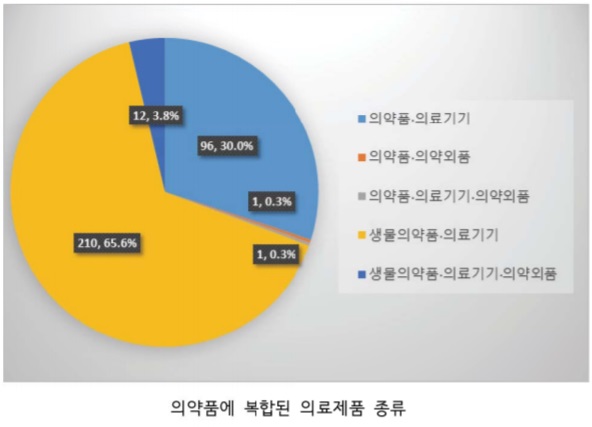
허가 제품 구성을 보면, 생물의약품+의료기기 융합제품이 210개로 절반 이상을 차지했고(65%), 의약품+의료기기 융합제품도 96개(30%)로 1/3 정도로 뒤를 이었다.
제품 형태로는, 의약품을 전달·투여하기 위한 프리필드실린지(1회용 또는 멸균주사침)나, 자가 주사용 주입기(1회용 또는 멸균주사침을 포함하는 펜, 인젝터 또는 캐뉼라) 같은 의료기기와 복합된 형태가 가장 많았다(95.6%, 306개).
특히 생체이용률 증가를 위해 화학의약품(30.6%, 98개)보다는 유전자재조합단백질이나 백신 같은 생물의약품(69.4%, 222개)과 많이 복합됐다.
의료기기(프리필드실린지나 자가 주사용 주입기)에 반창고나 1회용 알콜솜/소독액과 같은 의약외품이 하나의 제품으로 포장되는 형태(4.1%, 13개) 및 살균 목적의 의약품을 포함하는 면봉(의약외품) 제품도 있었다(0.3%, 1개).
|
'주작용이 의료기기인 융복합 의료제품'은 현재 총 238개 품목으로, 첫 허가는 1998년이었고 2009년부터 급격한 증가세를 보이며 연간 15개 이상의 품목이 제품화됐다.
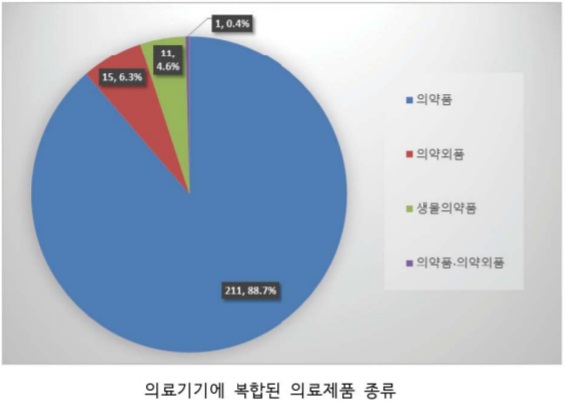
의료기기와 복합된 의료제품의 종류는 의약품, 의약외품, 생물의약품 및 의약품·의약외품 순으로 나타났다.
88.7%(211개)로 가장 많은 융복합 제품들이 항균, 면역반응억제 또는 혈액응고방지 등 못적으로 의약품을 사용했다.
거즈나 반창고와 같은 의약외품과 복합된 제품이 6.3%(15개), 유전자재조합 성장인자 단백질 등의 생물의약품과 조합된 제품이 4.6% 비중을 차지했으며, 의약품·의약외품·의료기기가 복합된 제품도 출시됐다(0.4%, 1개).
한편, 식약처는 2005년 2종 이상의 복합적 기능(DNA 진단 칩, 인공피부 등)을 가진 제품의 효율적 처리를 위한 '다기능의약품등 신속처리규정'이 제정됐으며, 2008년 '복합·조합품목 처리규정'으로 제명되면서 복합·조합 품목과 주작용 양식에 대한 정의 및 분류사례가 포함됐다.
이후 2017년 '복합·조합품목 등 민원신청 처리 등에 관한 규정'으로 제명되면서 복합품목과 분류가 불분명한 품목에 대한 세부사항이 추가됐으나, 최근 인공지능, 3D프린팅, 수술로봇 등 첨단기술과 융합된 복합 의료제품의 신속허가를 위한 새로운 패러다임이 요구되면서 올해 3월 '융복합 혁신제품 지원단'이 출범하게 됐다.
전체댓글 0개
등록된 댓글이 없습니다.
오늘의 헤드라인
-
01 블루엠텍, 한국노바티스 ‘렉비오’ 개원가 유... -
02 케어젠,멕시코 'IFA 셀틱스'와 450억원 규모... -
03 제약·바이오·건기식 산업 잇는 실질적 글로... -
04 아이델비온, 글로벌 혈우병 B 치료제 시장... -
05 파미셀, 상반기 매출 538억·영업익 165억…"... -
06 에이비엘바이오 "컴퍼스 'ABL001' OS 개선 ... -
07 식약처, ‘화장품의 날’ 법정 기념일 지정 행... -
08 뉴메코, 차세대 보툴리눔 톡신 제제 ‘뉴럭스... -
09 칼리시,약물 독성 예측 패러다임 전환 연구... -
10 알피바이오, 의약품 표준제조기준 개정 대응...











