심평원 “임상적 유용성과 비용효과성 종합 검토해 접근성 높일 것”

|
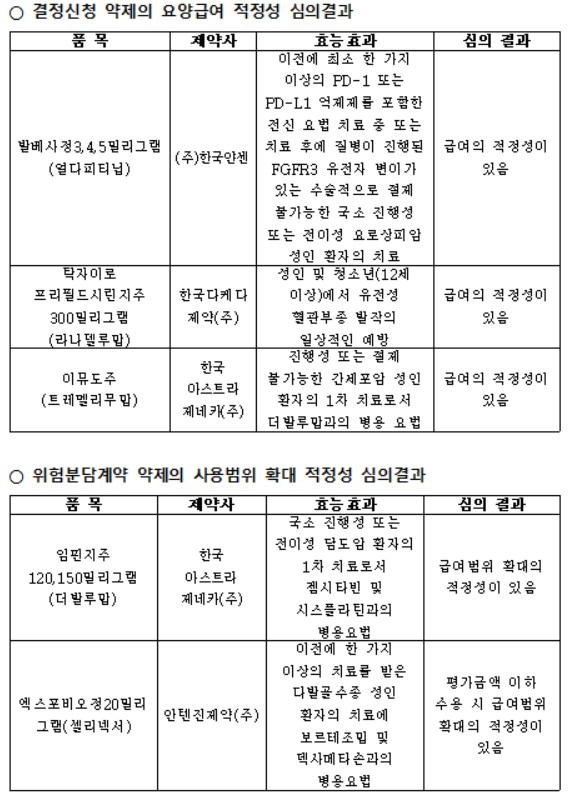
건강보험심사평가원(원장 강중구)은 6일 2025년 제11차 약제급여평가위원회(약평위) 결과를 공개하고, 결정신청 약제 3건과 위험분담계약 약제 2건의 급여 적정성 심의 결과를 발표했다.
이번 회의에서는 담도암·간세포암 등 항암분야 주요 약제의 급여 적용 확대와 희귀질환 치료제의 접근성 개선이 주요 성과로 꼽힌다.
위험분담계약 약제 심의에서는 한국아스트라제네카의 ‘임핀지주(더발루맙)’가 ‘국소 진행성 또는 전이성 담도암 환자의 1차 치료로서 젬시타빈 및 시스플라틴 병용요법’에 대해 급여범위 확대의 적정성이 있음으로 평가됐다.
임핀지는 2022년 국내 허가된 담도암 최초의 면역항암제로, 장기생존 데이터를 확보했음에도 급여 문턱을 넘지 못해왔던 약제다. 이번 결정으로 10년 만에 담도암 1차 치료에 급여 신약이 추가되며, 환자들이 글로벌 표준치료를 적용받을 수 있게 됐다. 현재 임핀지는 미국·영국·일본 등 주요 8개 참조국 및 대만에서도 이미 급여가 적용되고 있다.
함께 논의된 ‘엑스포비오정(셀리넥서, 안텐진제약)’은 ‘이전에 한 가지 이상의 치료를 받은 다발골수종 성인 환자의 치료에서 보르테조밉 및 덱사메타손 병용요법’으로 평가금액 이하 수용 시 급여범위 확대의 적정성이 있음으로 조건부 인정됐다.
결정신청 약제 심의에서는 △발베사정(얼다피티닙, 한국얀센) △탁자이로 프리필드시린지주(라나델루맙, 한국다케다제약) △이뮤도주(트레멜리무맙, 한국아스트라제네카) 등 3개 품목이 모두 ‘급여의 적정성이 있음’으로 평가됐다.
발베사정은 FGFR3 유전자 변이가 있는 절제 불가능한 국소 진행성 또는 전이성 요로상피암 환자를 대상으로, PD-1 또는 PD-L1 억제제 치료 후 질병이 진행된 환자군에서 사용된다.
탁자이로는 12세 이상 성인 및 청소년의 유전성 혈관부종(HAE) 발작 예방 치료제로, 2021년 국내 허가 이후 첫 급여 평가를 통과했다.
이뮤도주는 더발루맙(임핀지)과 병용하는 간세포암 1차 치료제로, 지난해 약평위에서 보류된 이후 재심을 통해 급여 적정성을 인정받았다.
이뮤도·임핀지 병용요법은 이미 미국, 프랑스, 독일, 일본, 영국 등 주요국에서 급여가 적용 중으로, 한국도 이번 결정으로 국제 기준과 보조를 맞추게 됐다.
-
01 약평위, ‘임핀지’ 담도암 1차 치료 급여 확... -
02 지난해 글로벌 임상시험 적응증 1위 '종양... -
03 GC녹십자, AI 머신러닝 기반 ‘혈우병 환자 ... -
04 라셀릭, 하이브리드 세포 시스템 ‘Evo-Stem,... -
05 리가켐바이오, World ADC Awards 2개 부문 ... -
06 큐로셀, LIMS-ERP 통합…CAR-T 상업화 ‘속도·... -
07 로킷헬스케어, 매출 173% 급증…상장 후 2분... -
08 대한안과학회 “근시, 단순 시력 저하 아냐…... -
09 한국파마, 철 결핍증 치료제 ‘아크루퍼캡슐’... -
10 경보제약, 산업부 ‘AI 기반 의약품제조 자율...











