
|
화학, 표적, 면역항암제에 이어 대사항암제(Metabolic anticancer drug)가 항암제 분야의 한획을 그을 4세대 항암제로 꼽히고 있다. 최초 대사항암제 ‘아이드하이파(Idhifa)’의 실사용 데이터가 일정 수준 확보됐고, 매출도 지속해서 증가해 3000억원을 넘어섰다.
대사항암제는 암의 다양한 유발 원인 중 공통으로 나타나는 ‘대사 과정(Metabolic)’을 타깃, 여러 암종에 모두 작용할 수 있는 항암제를 말한다. 즉, 한가지 약물로 대장암, 위암, 혈액암 등을 한 번에 치료할 수 있는 획기적인 항암제다.
지니너스 유전체사업실 이시영 연구원은 ‘4세대 대사항암제 개발 동향 보고서’를 통해 “대사항암제는 기존 표적·면역항암제의 한계인 항암 효과 타깃에 대한 한정된 반응성을 극복할 수 있는 대안”이라며 “화학항암제와 면역항암제의 병용투여 전략과 같이 암 환자를 치료할 수 있는 또 하나의 유망한 전략”이라고 30일 평가했다.
암은 신체 외부에 의한 요인으로 발생하기보단 자신의 신체 조직에서 자기 세포의 변이에 따라 생기는 질환으로 볼 수 있다. 대부분은 유전적 변이 때문에 암이 유발된다. 어떤 유전자에서 변이가 나타날 때는 암세포의 성장·분화·분열을 촉진시키는 발암유전자(Oncogene)가 작용한다. 이때 종양억제인자(Tumor suppressor gene)에 변이가 생겨 제 기능을 못해 암이 발생하게 된다.
이처럼 암은 다수 유전자 변이 외에도 수많은 발생 원인을 가지고 있고 특성 또한 제각기다. 그러나 다양한 원발부위의 암에서 공통적인 특징이 있다. 대표적으로 △제한 없는 무한 세포분열(Sustaining proliferative signaling) △혈관 생성 촉진(Inducing angiogenesis) △세포사멸 저항(Resisting cell death) 등이다. 이 공통적인 특성을 타깃하는 게 대사항암제다.
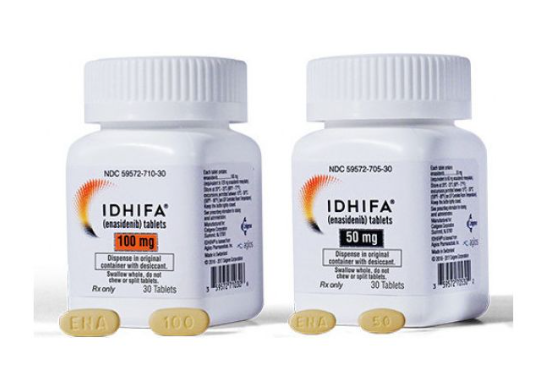
지금까지 승인된 대사항암제는 BMS의 ‘아이드하이파’ 단 하나다. 아이드하이파는 세엘진(Celgene)과 애지오스 파마슈티컬스(Agios Pharmaceuticals)가 공동 개발한 급성골수성백혁병 치료제로, 2017년 8월 1일 FDA에 승인됐다.
|
아이드하이파는 임상 3상에서 특정 유전자(IDH2) 돌연변이가 확인된 재발 또는 불응성 급성골수성백혈병 환자 199명을 대상으로 6개월간 투여했을 때, 환자 19%에서 완전관해 상태가 8.2개월 지속되는 것으로 나타났다. 특히 해당 질환으로 혈액 및 혈소판 수혈이 필요한 환자 157명 중 34%는 더는 수혈이 필요하지 않았다.
BMS는 2019년 1월 세엘진을 740억 달러(약 97조 8000억원)에 인수하며 아이드하이파를 확보했다. 이어 아이드하이파는 2021년 12월 프랑스 제약사 세르비에(Servier)에 20억 달러(약 2조 6000억원)에 이전됐다. 아이드하이파 글로벌 매출은 2020년 기준 1억 5000만 달러(약 2000억원)로 추산됐고, 2022년에는 2억 2000만 달러(약 3000억원)로 증가세를 보이고 있다.
전문가들은 암의 공통적인 대사 특이적 특성을 타깃하는 대사항암제가 기존 표적항암제, 면역항암제의 한계를 극복할 수 있을 것으로 기대하고 있다. 키트루다(Keytruda)로 대성공한 3세대 면역항암제(Cancer immunotherapy)는 환자의 암세포 특징뿐만 아니라 환자의 면역세포들의 활성을 조절, 암을 스스로 제거할 수 있는 환경을 만들어 항암 효과를 낸다. 그러나 면역항암제는 한계가 뚜렷하다. 키트루다는 PD-L1 등 암세포에 특이적으로 발현되는 단백질을 감지, 이 방어막을 무력화 시키는 작용을 가진 항암제다. PD-L1 계열이 아닌 또 다른 방어막을 암세포가 치면 키트루다는 효과를 볼 수 없다.
대사항암제는 정상세포의 에너지 대사와 암세포의 에너지 대사에서 차이가 나는 부분을 공략, 부작용 없이 효과를 보이는 것을 목표로 한다. 정상세포는 대부분 에너지 대사 과정에 산소가 필요한 호기성 조건에서 이뤄진다. TCA 회로를 중심으로 포도당을 피루브산으로 전환시키며 ATP(Adenosine triphosphate)와 NADH( Nicotinamide adenine dinucleotide)를 만들어내는 것을 기본으로 세포의 생명을 유지한다. 반면 암세포는 급속한 성장과 불규칙한 분열로 에너지 대사가 정상세포와는 다르게 진행된다. 이 과정에서 호기성 조건이 아닌 혐기성 조건에 독특한 대사과정을 보인다.
오토 바르부르크(Otto Warburg) 박사는 1920년 포도당을 이용한 산화적 인산화(Oxidative phosphorylation) 과정이 아닌, 해당과정(Glycolysis)에서 생성된 젖산을 이용해 에너지를 만들어 내는 것을 밝혀냈다. 아울러 미토콘드리아의 산화적 인사화 과정을 동시에 증가시키거나 주변 환경에 영향을 미쳐 복합적인 대사활동이 암세포의 성장을 돕는 것을 확인했다. 이러한 효과를 호기성 해당과정(Aerobic glycolysis)인 ‘바르부르크 효과(Warburg effect)’로 명명했다. 현재 이 암 대사의 이질적인 부분들을 바이오마커로 해, 신약 연구개발이 진행 중이다.
이 연구원은 “오랫동안 신체 및 암 대사가 연구됨에 따라 높은 이해도를 바탕으로 약물이 개발되고 있다”면서 “다수의 완전관해 사례가 보고되고 있는 만큼, 향후 효과적이고 안전한 대사항암제 개발이 기대된다”고 전했다. 그러면서도 그는 “항암제의 트렌드를 바꾸기 위해선 실제 임상 현장에서의 사용 데이터가 더 필요하다”고 평가했다.
-
01 건강기능식품은 내수 전용, 인식 벗을까? -
02 휴온스그룹, 창립 60주년…글로벌 헬스케어 ... -
03 프로젠, 유럽 당뇨병학회서 'PG-102' 연구성... -
04 미국 FDA, 의약품 '보안요구서한'(CRL) 202... -
05 뉴로핏 "10년간 뇌질환 영상 진단만 팠다…26... -
06 옵디보·여보이, 간세포암 1차 치료 대한 적... -
07 “살아남을 시간이 없다”… 빌로이, 전이성 위... -
08 에피바이오텍,모낭 싱글셀 분석- 탈모 원인 ... -
09 화해, 글로벌 인플루언서 시딩 프로그램 정... -
10 롯데바이오로직스 "앱티스와 차세대 ADC 기...











