뉴스
시가테크놀로지스 원숭이두창 치료제 '티폭스' FDA 공식 승인 될까?
유럽 EMA·영국 MHRA 원숭이두창 치료제로 승인…미 FDA 특별 조건 하에서만 사용 중
권혁진 기자 │ hjkwon@yakup.com


입력 2022-08-16 06:00 수정 2022.08.16 06:00
|
원숭이두창(Monkeypox)은 원숭이두창바이러스에 감염돼 발생하는 희귀질환으로, 지난 1958년 연구를 위해 사육된 원숭이들에서 수두와 비슷한 질병이 처음 발견돼 '원숭이두창'으로 불리고 있다. 인수공통감염병으로 비말, 피부 접촉 등으로도 감염된다. 발열과 두통을 비롯해 얼굴을 중심으로 발진증상이 나타나며, 팔과 다리로 발진이 확산되는 증상이 나타난다. 지금까지 상용화된 전용 치료제는 없으며, 항바이러스제 등이 치료에 사용되고 있다.
현재 미국 시가 테크놀로지스(SIGA Technologies, Inc)의 천연두치료제 '티폭스(Tpoxx)'가 원숭이두창 치료제로 사용되고 있다. 티폭스는 지난 1월 유럽의 EMA와 지난 7월 영국의 MHRA 등 유럽 의약품 규제기관으로부터 원숭이두창 치료제로써 사용이 승인(Approval)됐다. 반면 미국 FDA에서는 현재까지 원숭이두창 치료제로써 사용 승인(Approval)은 이뤄지지 않았다.
이에 한국바이오협회 바이오경제연구센터에서는 '미국은 왜 원숭이두창 치료제 승인을 미루나?' 이슈 브리핑을 통해 티폭스의 향후 전망을 전했다.
FDA 질병관리예방센터(CDC)는 티폭스가 사람을 대상으로 원숭이두창에 대한 유효성과 사용 안전성의 자료가 없어, 승인이 불가한 상황이라고 밝혔다. 동물실험에서 유효성이 있는 의약품이 사람에게도 동일한 효능이 나타나는 것은 아니라며, 무작위 대조 임상시험(RCT)을 통해 평가해야 한다는 입장이다.
그러나 티폭스는 지난 2018년 'Animal Rule' 규정에 따라 천연두 치료제로 승인된 제품이다. Animal Rule은 사람에게 임상시험이 불가한 질병에 대해서 동물모델에서의 유효성과 안전성 데이터를 근거로 사람에게 사용이 승인되는 규정이다. 현재까지 천연두, 보툴리눔 독소, 탄저균, 청산(Cyanide) 중독, 방사능, 신경작용제 등 16개 의약품이 승인됐다.
|
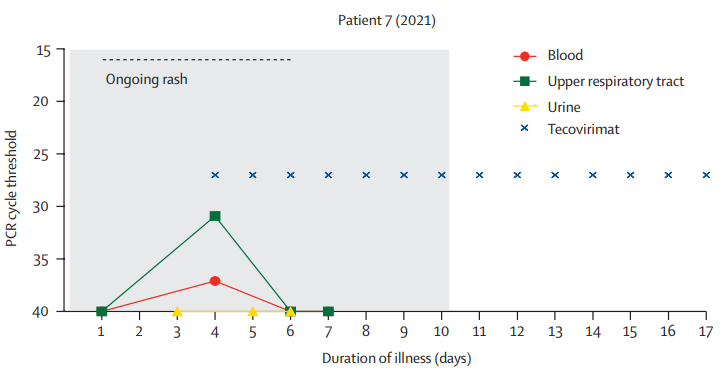
▲티폭스(Tecovirimat) 투여 후향적 임상연구 자료 일부 발췌(출처:Clinical features and management of human monkeypox: a retrospective observational study in the UK, Lancet)
이에 따라 티폭스는 향후 원숭이두창 치료제로써 미 FDA 공식 승인을 받을 것이라는 의견이 제시되고 있다. 티폭스는 동물실험에서 원숭이두창 감염으로 인한 사망 위험을 감소시키는 결과가 확인된 바 있다. 또한 유수의 의학저널 란셋(Lancet)에 지난 8월 1일 게재된 관련 연구결과에서는 7명의 원숭이두창 감염 환자 중 티폭스를 사용한 1명에게서 6명에 비해 질병 지속 기간과 바이러스 배출(Viral shedding)에서 감소가 확인됐다.
특히 국립보건연구원(NIH)에서는 지난 3일 원숭이두창에 감염된 에이즈 환자를 대상으로 티폭스 임상시험을 진행할 계획을 밝혔고, 미국 보건부는 지난 9일 시가 테크놀로지스와 2,600만 달러 규모의 정맥주사용 티폭스 공급 계약을 맺었다. 이는 입안에 발진과 수포로 경구용 투여가 어려운 환자를 위한 것으로 추정되고 있다. 이와 더불어 지난 5월에도 미국 국방성과 시가 테크놀로지스가 750만 달러 규모의 경구용 티폭스 조달 계약을 맺은 바 있어, 티폭스의 미 FDA 공식 승인 가능성은 높게 점처지고 있다.
전체댓글 0개
등록된 댓글이 없습니다.
오늘의 헤드라인
-
01 JW홀딩스, 창립 80주년 맞 ‘모두가 건강 안... -
02 건일제약, 문희석 공동 대표이사 선임 -
03 보령-삼성바이오에피스, 골질환 치료제 ‘엑... -
04 지노믹트리 ‘얼리텍-B 검사’, 상부요로상피... -
05 온코닉테라퓨틱스,'자큐보정' 비미란성 위식... -
06 알피바이오,프로바이오틱스-기능성 오일 결... -
07 쎌바이오텍, ‘듀오락 CBT 유산균’ 만성콩팥... -
08 "기술거래 부르는 ADC 따로 있다" 리가켐바... -
09 5월 화장품 온라인거래액 1조 1387억원…7개... -
10 상반기에만 55억 달러…올해 화장품 수출 '기...











