뉴스
미국, 마스크·가운 등 FDA 절차생략 품목 확대
4월 초부터 재량적 집행 지침 발표…통관시 2개 코드 활용
이승덕 기자 │ duck4775@yakup.com


입력 2020-04-13 06:00 수정 2020.04.13 07:30
최근 코로나19가 확산되고 있는 미국에서 일반 마스크, 의료용 가운 등 FDA 승인절차 생략 품목이 확대돼 수출 가능성이 높아졌다.

|
보고서에 따르면, 미국 내 코로나19의 대유행으로 개인보호장비 및 인공호흡기 공급난이 심화되면서 미국 식품의약국(U.S. Food and Drug Administration, FDA)은 관련 품목의 수입을 원활히 하기 위해 수입업체를 위한 지침을 발표했다.
발표된 지침은 수입업체에 미국 식품의약국에서 응급사용승인(emergency use authorization, EUA)을 받아 의료기기 규제 준수를 면제받고 수입할 수 있는 개인보호장비와 의료기기의 유형을 안내하고 있다.
또한 합법적인 의료장비의 통관을 신속화하기 위해 통관 서류 제출 방법에 관한 정보를 제공했다.
FDA는 이번 발표된 지침을 준수하면 코로나19 공중 보건 비상사태 관련 물품의 수입절차를 신속히 진행할 수 있다고 밝혔다.
질병 예방 목적이 아닌 범용 및 산업용 개인보호장비(마스크, 장갑 등)는 FDA의 규제를 받지 않으므로 식품의약국에 정보를 제출 하지 않아도 된다.
대신 수입업체는 미국 관세국경보호청(U.S. Customs and Border Protection, CBP)의 전자수입통관(Automated Commercial Environment, ACE) 시스템을 통해 통관정보를 제출해야 한다. 이 때 FD 서표(flag)가 없는 적절한 HS코드를 사용하거나 FD1 서표가 있는 HS를 사용하고 식품의약국 리뷰를 '거절(disclaim)' 하도록 안내하고 있다.
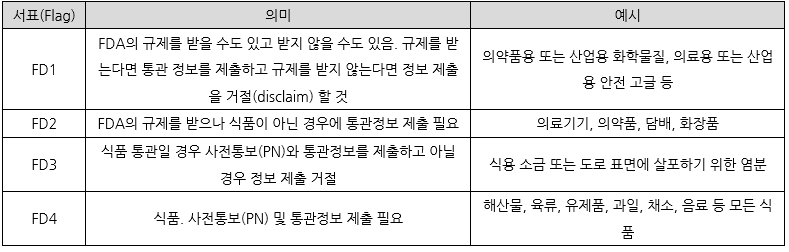
|
범용 및 산업용 개인보호장비로 수입된 제품은 FDA 의료기기 규제 준수 없이 의료용 목적으로 마케팅되거나 판매될 수 없다.
FDA의 응급사용 승인을 얻은 제품이라도 CBP의 전자수입통관(ACE) 시스템을 통해 식품의약국에 통관 정보 제출이 요구된다. 그러나 FDA은 검토를 위해 일반 의료기기 통관보다 축소된 양의 정보만을 요구해 절차가 간편해 졌다.
응급사용승인(EUA)를 얻은 제품의 '의도된 용도 코드(Intended Use Code)'는 940.000(응급사용기기)이며, FDA의 신속한 리뷰를 위해 제품에 적합한 '식품의약국 제품 코드(FDA Product Code)'를 제출해야 한다.
해당 두 가지 코드를 전자수입통관(ACE) 시스템에 제출하면 일반적인 의료기기 수입 시 요구되는 FDA의 의료기기 규제(등록, 리스팅, 시판전 신고 등) 준수 정보는 비필수사항이다.
코로나19 관련 응급사용승인(EUA)을 받을 수 있는 품목은 체외진단기, 검사실 자체 개발 분자진단검사(High Complexity Molecular-Based Laboratory Developed Tests), 개인보호장비, 인공호흡기 및 기타 의료기기, 치료제이다.
4월 5일 기준 응급사용승인을 받은 제품은 28개 체외진단기와 4개의 분자진단검사, N95 또는 성능이 N95에 준하는 마스크, 인공호흡기, 하이드록시클로로퀸 등이다.
미국 관세국경보호청에 따르면 4월 5일 기준 아래의 식품의약국 제품 코드(FDA Product Code)만이 응급사용승인을 받은 품목에 해당된다.
FDA가 의료기기로 규제하는 제품 중 응급사용승인을 받지 않았으나 재량적 집행(enforcement discretion) 지침이 발표된 제품은 미국으로 수입 시 CBP의 전자수입통관(ACE) 시스템을 통해 FDA에 통관 정보를 제출해야 한다.
통관 시 수업업체는 '의도된 용도 코드(Intended Use Code)'로 081.006(최종 지침에 따른 재량적 집행)을 선택하고 적합한 '식품의약국 제품 코드(FDA Product Code)'를 제출해야 한다.
응급사용승인을 얻은 경우와 마찬가지로 두 가지의 코드를 사용하면 일반적인 의료기기 수입 시 요구되는 FDA의 의료기기 규제(등록, 리스팅, 시판전 신고 등) 준수 정보는 비필수사항이다.
현재까지 코로나19와 관련해 재량적 집행 지침이 발표된 품목은 △체온계 △의료용 가운 및 의류, 장갑 △살균·소독기 및 공기청정기 △마스크 △비침투적 원격 모니터링 기기 △인공호흡기 및 액세서리 등이다.
또한 응급사용승인을 통한 통관, 식품의약국 제품코드 및 기타 문의사항은 코로나19 FDA 수입문의 메일(COVID19FDAIMPORTINQUIRIES@fda.hhs.gov)과 전화(+1(미국)-301-796-0356)를 통해 할 수 있다.
임소현 무역관은 "미국 정부는 코로나19 확산에 따른 물품 부족에 대응하기 위해 응급사용승인(EUA)을 시행했으나 최근까지는 N95를 제외한 대부분의 마스크, 의료용 가운, 장갑 등 광범위한 품목은 해당되지 않아 혜택을 받기 어려웠다"며 "그러나 4월 초 응급사용승인을 받을 수 없었던 이들 품목에 대해 재량적 집행이 대거 발표되면서 코로나19 기간 FDA 절차를 생략 후 통관 가능한 범위가 확대됐다"고 설명했다.
이어 "미국에 관련 품목을 수출하기 원하는 우리 기업은 FDA에서 품목별 허가명령(Letter of Authorization) 원문을 직접 확인해 제품의 상세 규격 및 성능이 부합하는지 확인 후 적절한 절차에 따라 미국 수출을 진행해야 한다"며 "직접 확인하는데 어려움이 있을 경우 FDA 인증 컨설팅 업체의 도움을 받거나 FDA에 문의해 볼 수 있다"고 안내했다.
[관련기사]
코로나19 아이러니한 교역 확대-의약품·마스크 등 '1조 달러'
2020-04-10 06:00
전체댓글 0개
등록된 댓글이 없습니다.
오늘의 헤드라인
-
01 바이오노트,CTC바이오 추가 지분 인수... ... -
02 옙바이오, KDDF 심포지엄서 글로벌 빅파마와... -
03 VNTC "미국 이노비스와 척추측만증 교정기 '... -
04 에이비엘바이오, 독성 한계 극복 '4-1BB 단... -
05 이노크라스-STREAM 컨소시엄, 이건희 소아암... -
06 압타머사이언스, 신약개발 기업과 압타머 발... -
07 대한약사회, 30일 ‘한약사 문제 해결’ 대정... -
08 미국, 10월 1일부터 의약품 100% 관세 부과.... -
09 콜마비앤에이치 사내이사로 윤상현·이승화 선임 -
10 아이넥스 'ENAD CADx',대장내시경 AI 분야 ...











