뉴스
과민성 腸증후군 수반 통증 완화 의료기기 승인
IBS 수반 기능성 복통 감소 용도 귀 부착 ‘IB-스팀’
이덕규 기자 │ abcd@yakup.com


입력 2019-06-12 05:30 수정 2019.06.12 05:35
|
FDA가 과민성 대장증후군(IBS) 환자들에게 수반되는 기능성 복통을 완화시켜 주는 의료기기의 발매를 7일 승인했다.
이 같은 유형의 의료기기가 FDA로부터 발매를 승인받은 것은 이번이 처음이다.
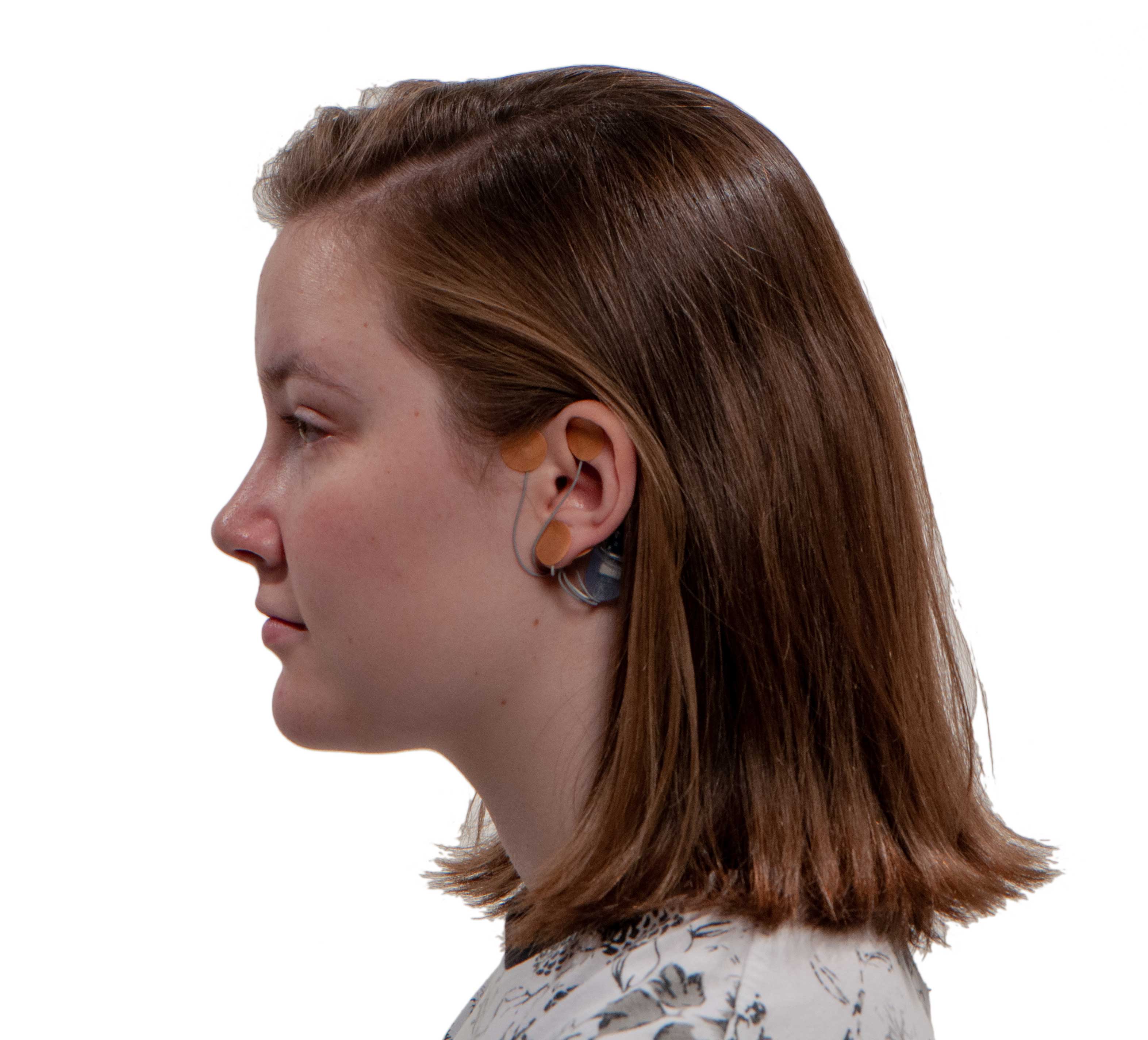
인디애나州의 주도(州都) 인디애나폴리스에 소재한 의료기기 메이커 이노버티스 헬스 솔루션社(Innovative Healthg Solutions)의 ‘IB-스팀’(IB-Stim)이 바로 그것.
‘IB-스팀’은 11~18세 연령대 과민성 대장증후군 환자들이 약물치료와 병행해 사용할 경우 기능성 복통의 통증을 완화시켜 주는 용도의 의료기기이다.
FDA 의료기기‧방사선건강센터(CDRH) 신경‧물리치료기기관리국의 카를로스 페냐 국장은 “이 의료기기가 청소년 과민성 대장증후군 환자들에게 경도(輕度) 신경자극을 이용해 통증을 완화하는 안전한 치료대안으로 각광받을 수 있을 것”이라고 말했다.
그는 뒤이어 “오늘 결정이 소아환자용 의료기기의 개발을 위해 지속적으로 힘을 기울여 소아 및 청소년 환자들이 그들의 니즈를 충족시켜 줄 안전하고 효과적인 의료기기들에 대한 접근성이 확보될 수 있도록 힘쓰고 있는 FDA의 노력을 방증하는 것”이라고 덧붙였다.
‘IB-스팀’은 환자의 귀 뒷면에 부착하기 위한 작은 크기의 일회용 전동 신경자극기로 구성되어 있는 처방용 의료기기이다. 배터리로 구동하는 칩이 내장되어 있어 한번 부착하면 5일 동안 지속적으로 뇌신경의 일부를 자극하는 저주파수 전기파를 방출하는 원리로 작동된다.
신경묶음(nerve bundles)과 귀 주위를 자극하면 통증을 완화시킬 수 있는 것으로 사료되고 있다.
환자들은 ‘IB-스팀’을 5일이 경과했을 때 위치를 변경해 다시 부착하는 방식으로 최대 3주 동안 연속해서 사용하면서 과민성 대장증후군과 관련이 있는 기능성 복통을 완화시킬 수 있다.
FDA는 11~18세 연령대 과민성 대장증후군 환자 50명이 피험자로 참여한 가운데 진행된 1건의 임상시험에서 도출된 자료를 분석한 끝에 이번에 ‘IB-스팀’의 발매를 승인한 것이다.
이 시험에서 27명의 환자들은 ‘IB-스팀’을 사용했고, 나머지 23명은 플라시보 의료기기를 사용했다.
‘IB-스팀’의 효과는 가장 심한 복통, 통상적인 복통 및 ‘통증 빈도‧중증도‧지속기간’(PFSD) 평가척도를 적용해 착수시점과 3주가 지난 경과시점의 변화도를 측정하는 방식으로 평가됐다. 腸 운동의 변화도는 평가대상에 포함되지 않았다.
시험에 참여한 기간 동안 피험자들은 만성 복통을 치료하기 위해 안정적인 용량의 약물치료를 지속할 수 있도록 허용됐다.
시험 착수시점에서 가장 심한 복통은 두 그룹이 대동소이하게 나타났다.
그런데 분석작업을 진행한 결과 ‘IB-스팀’을 사용한 가장 심한 복통 그룹은 착수시점과 종료시점의 변화도(즉, 개선도)가 가장 괄목할 만한 수준으로 나타나 주목되게 했다. 더욱이 이 같은 효과는 첫 번째 주와 두 번째 주에서도 같은 양상으로 관찰됐다.
마찬가지로 ‘IB-스팀’을 사용한 그룹은 PFSD 평가척도를 적용해 착수시점과 종료시점의 변화도를 측정했을 때에도 효과가 입증됐다. ‘IB-스팀’을 사용한 그룹의 경우 종료시점에서 52%가 통상적인 복통이 최소한 30% 감소한 것으로 분석된 반면 플라시보 기기 그룹에서는 30%만이 동등한 수준에 도달한 것.
또한 가장 심한 복통을 나타낸 가운데 ‘IB-스팀’을 사용한 그룹의 경우 59%에서 통증이 최소한 30% 감소해 플라시보 기기 그룹의 26%에서만 동등한 수준에 도달한 것과 격차를 내보였다.
시험이 진행되는 동안 6명의 환자들은 귀 부위에 경도(輕度) 불편함이 나타났으며, 3명은 ‘IB-스팀’을 부착한 부위에 접촉성(adhesive) 알러지가 나타난 것으로 보고됐다.
다만 FDA는 혈우병 환자, 심장박동 조율기를 사용 중인 환자 또는 심상성 건선을 진단받은 환자 등의 경우 ‘IB-스팀’의 사용을 금해야 할 것이라며 유의를 요망했다.
한편 FDA는 검토과정에서 신규(de novo) 시판 前 허가심사 절차를 진행한 끝에 ‘IB-스팀’의 발매를 승인한 것이다. 신규 시판 前 허가심사는 위험도가 저도에서 중등도에 해당하는 의료기기들의 승인 여부를 검토할 때 적용되는 절차이다.
‘IB-스팀’과 유사한 성격의 의료기기로는 앞서 마약성 제제 금단증상 완화용 의료기기 ‘NSS-2 브리지’(The NSS-2 BRIDGE)가 지난 2017년 FDA의 허가를 취득한 바 있다.
FDA는 ‘IB-스팀’과 유사한 유형의 의료기기를 승인한 것은 지난 2014년 침술에 사용하는 용도로 발매를 허가했던 ‘일렉트로 오리큘라 디바이스’(Electro Auricular Device)가 처음이었다.
전체댓글 0개
등록된 댓글이 없습니다.
오늘의 헤드라인
-
01 명인제약, CNS 경쟁력·펠렛 제형 앞세워 코... -
02 셀루메드, 피부이식재 '셀루덤 파워' 제조 ... -
03 뉴메코, 보툴리눔 톡신 제제 ‘뉴럭스’ 볼리... -
04 케어젠,필러 의료기기 인도 CDSCO 등록 완료 -
05 제이투에이치바이오텍, '케이캡' 결정형 분... -
06 동방에프티엘, ‘니르마트렐비르’ WHO PQ- WH... -
07 OATC, 화장품 향 알레르기 유발물질 검사 항... -
08 한미약품,당뇨약 멕시코 공급 계약...중남미... -
09 유한양행, 휴이노와 '메모큐' 판매 계약 MOU... -
10 콜마비앤에이치, 서초구청·기빙플러스와 장...











