뉴스
식약처, 한국로슈 등 바이오의약품 해외제조소 12곳 현지 실사
약사법규 준수 여부, 밸리데이션 등 위해요인 집중 점검
김용주 기자 │ yjkim@yakup.com


입력 2019-02-20 06:20 수정 2019.02.20 06:36
한국로슈의 미국 공장 등 해외 바이오의약품 제조소 12곳에 대한 식약처의 현지 점검이 실시된다.
식품의약품안전처는 19일 개최된 '2019 바이오의약품 정책 허가심사 설명회'에서 바이오의약품 해외제조소에 대한 집중감시를 강화할 방침이라고 밝혔다.
실사 이력, 국내외 품질문제 발생현황, 수입실적 등 국내시장에 미치는 영향을 고려해 현지실사 업체를 선정하겠다는 것이다.
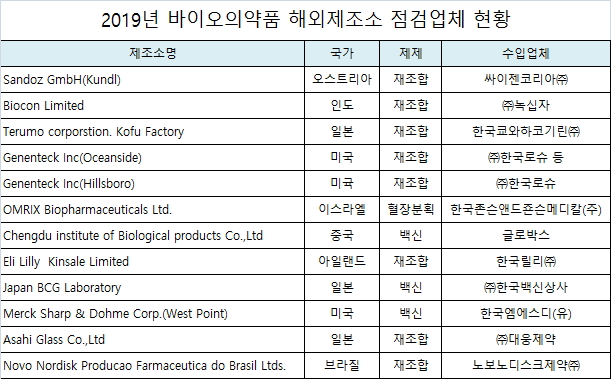
식약처가 올해 점검할 해외 바이오의약품 해외제조소는 싸이젠코리아㈜, ㈜녹십자, 한국쿄와하코기린㈜, ㈜한국로슈, 한국존슨앤드죤슨메디칼(주), 글로박스, 한국릴리㈜, ㈜한국백신상사, 한국엠에스디(유), ㈜대웅제약, 노보노디스크제약㈜ 등이다.
이들 선정된 업체에 대해서는 제조소 총람(Site Master File),최근 3년간 규제기관 실태조사 이력, 품목별 제품품질(PQR)자료, 주요 변경관리자료 등 사전제출자료 검토를 통해 제조소 위해등급을 평가한 후 현지살사를 진행한다는 계획이다.
주요 점검사항은 △약사법규 준수 확인 여부 확인 △위해요인 분석 결과에 따른 중점 점검사항 확인 △인체·품질에 미치는 영향 등 위해요인(RISK)을 분석해 중요항목(무균· 멸균 밸리데이션, 연간품질평가, 변경·일탈관리) 집중 점검 등이다.
|
전체댓글 0개
등록된 댓글이 없습니다.
오늘의 헤드라인
-
01 서울에 모인 한·중 제약바이오 리더들…"전략... -
02 "유전체데이터 혁신 앞장" NDS, 'AWS 퍼블릭... -
03 디티앤씨알오, '대한민국 일자리 으뜸기업' ... -
04 해외 의약품 제조소, 미국 FDA ‘기습 불시 ... -
05 아리바이오, 저주파 음향진동 전자약 기술 S... -
06 케어젠, 튀르키예 ‘아타바이’ 와 펩타이드 ... -
07 국내 연구진, 줄기세포 기반 인공혈액 대량... -
08 UNICEF “전세계 비만아동 최초 저체중아 추월” -
09 헐리우드와 빅파마 만남…줄리안 무어-릴리 ... -
10 MoCRA 제대로 모르면 낭패, 선케어 미국 수...











