
|
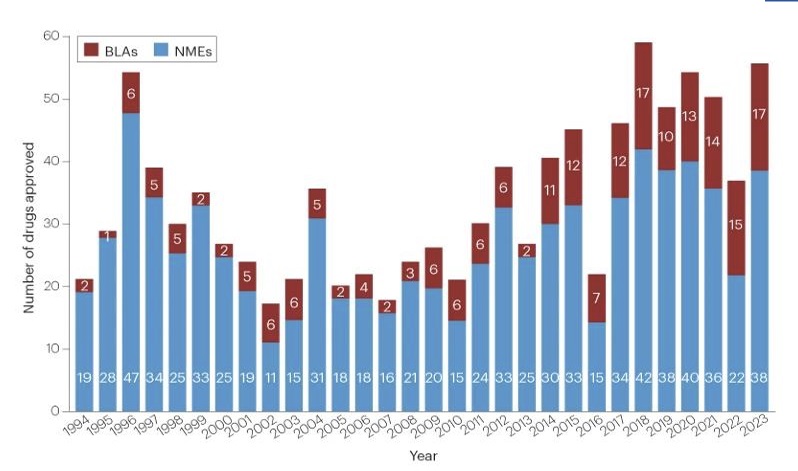
미국 식품의약국(FDA)이 의약품 평가연구센터 기준 지난해 총 55개의 신약을 승인한 것으로 확인됐다. 적응증 유형별로는 암 치료제(oncology)가 13건으로 가장 많았다.
국가신약개발사업단은 ‘지난해 FDA 신약 승인 현황’을 분석해 이같이 밝혔다.
사업단에 따르면 지난해 FDA는 의약품 평가연구센터(CDER)에서 55개, 생물의약품 평가연구센터(CBER)에서 16개 등 총 71개의 신약을 승인했다. 전년인 2022년의 승인 건수가 총 45건인 점을 감안하면 지난해 승인 건수는 크게 증가했다. 특히 CDER 기준으로는 약 50% 증가한 것으로 나타났다.
승인 내역을 적응증 유형별로 살펴보면, 암 치료제가 24%인 13건 승인돼 가장 큰 비중을 차지했다. 이어 신경질환(Neurology)이 9건, 감염성 질환(Infectious diseases)과 혈액 질환(Haematology)가 각각 5건씩 승인받았다.
모달리티 유형별로는 저분자 신약(Small molecules)이 총 34건으로 62%를 차지해 가장 많았다. 이어 단일항체 8건과 이중항체 4건 등을 포함한 단백질 신약(Proteins)은 총 17건 승인됐다. RNA 압타머 제품 승인(1건)을 포함한 올리고뉴클레오타이드(Oligonucleotides) 치료제 승인은 총 4건이었다.
반면 지난해 FDA가 승인을 거절한 약물은 △도나네맙(일라이릴리) △오메캄티브 메카빌(사이토키네틱스) △인바키셉트(이뮤니티바이오) △콘시주맙(노보 노디스크) △오베티콜릭산(알파시그마) △아바소파젬 망간(갈레라) △레브리키주맙(일라이릴리) △게파픽산트(머크) 등이 있다. 주라놀론(세이지)은 기존에 신청한 주요 우울장애로는 거절됐으나 산후우울증 치료제로 지난해 8월 승인받았다.
네이쳐리뷰지가 소개한 올해 주목할 만한 파이프라인은 19개다. △졸베툭시맙(Zolbetuximab) △리필류셀(Lifileucel) △레스메티롬(Resmetirom) △소타터셉트(Sotatercept) △mRNA-1345 △도나네맙(Donanemab) △EB-101 △파트리투맙 데룩스테칸(Patritumab deruxtecan) △이메텔스탯(Imetelstat) △탈라타맙(Tarlatamab) △피다나코진 엘라파보벡(Fidanacogene elaparvovec) △벤트라시맙(Bentracimab) △크로발리맙(Crovalimab) △다니코판(Danicopan) △미도마페타민(Midomafetamine) △KarXT △아코라미디스(Acoramidis) △마스타시맙(Marstacimab) △아파미셀(Afami-cel) 등이다.
-
01 앱클론,“AC101,임상3상 이미 40%" ...JPM서... -
02 현대바이오, 서울대병원과 '전립선암 가짜내... -
03 로킷헬스케어, “4주 완전 발모” 역노화 기술... -
04 애드바이오텍, H9N2 저병원성 조류인플루엔... -
05 알테오젠,2030년까지 9개 이상 품목 상업화-... -
06 휴젤, 2028년까지 전사 매출 9천억원-미국 ... -
07 프롬바이오,탈모 줄기세포치료제 반복투여 ... -
08 그린리본,디지털헬스케어·AI·RWD 결합 ‘그린... -
09 LG화학,수술 후 통증 관리 장기지속형 비마... -
10 에피바이오텍 성종혁 대표 “비만 혁신 다음...











