뉴스
의약품 임상시험 안전성 기준↑, 안전성정보 보고 신약부터 단계적 확대
임상연구윤리센터 전체 임상시험 범위로 확대하고 다기관 통합심사 전산시스템 구축 23년부터 전면 가동
김상은 기자 │ kims@yakup.com


입력 2022-02-24 06:00 수정 2022.02.24 08:58
올해부터 의약품 임상시험 관리과정에서 임상시험대상자에 대한 안전성 기준이 보다 강화될 예정이다.
식약처는 최근 2019~2020년 정기실태조사를 바탕으로 22년도 임상시험 사후관리에 관한 가이드라인을 발표했다.
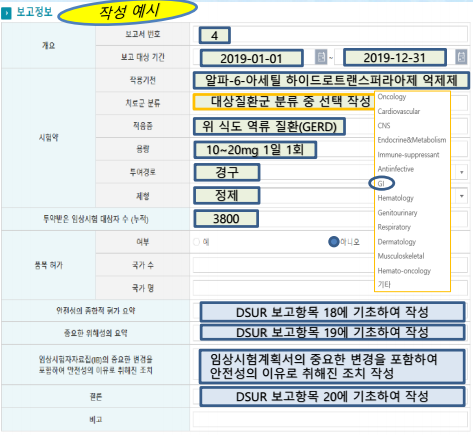
올해부터 임상시험용 의약품 최신 안전성 정보(DSUR)를 보고하는 과정이 신약부터 단계적으로 확대될 전망이다. 임상시험기관은 의약품 등의 안전에 관한 규칙(총리령) 개정 추진 방향에 따라 임상시험에 대한 포괄적인 안전성 정보를 분석, 평가한 내용을 제출해야 한다.
또한 올해부터 임상연구윤리센터의 범위를 넓혀 기존 기존의 코로나19 치료제·백신 및 항암제 분야에 한정됐던 범위를 전체 임상시험 범위로 확대해 나갈 전망이다. 또한 소규모 공동심사시스템을 활용하는 과정에서 임상학회와 협업해 분야별 전문가 자문단으로 구성된 심사과정으로 개편된다. 전문성을 강화하기 위해 다기관 통합심사 전산시스템 구축하여 23년에는 전격적으로 가동할 예정이다.
임상시험대상자의 권익보호를 위해 국가적 차원에서 실시되는 지원 체계도 마련된다. 올해부터 임상시험대상자 지원센터가 운영되면서 의사를 비롯한 의료 전문인력을 배치해 국내 임상시험의 신뢰 기반을 확대할 전망이다.
이를 제도적으로 뒷받침하기 위해 임상시험 검체분석 관리기준을 제정을 추진해 국제 수준의 분석결과를 내놓도록 임상 환경을 조성한다. 현행 비임상시험 관리기준에서 검체분석 관련 조항을 분리하고 임상시험 특성을 반영해 별도 관리기준을 마련한다.
한편, 지난 해까지 시행된 임상시험 기관 관리 기준에 따르면 자율점검기관은 자율점검계획 수립 및 이행, IRB 조치사항 이행여부, 자율점검 점검자의 자격 기준 여부를, 정기실태조사기관은 HRPP,AAHRPP 및 헬프데스크 운영 여부, 시설, 인력, 임상연구윤리센터(IRB) 등의 기준으로 평가돼왔다.
식약처는 최근 2019~2020년 정기실태조사를 바탕으로 22년도 임상시험 사후관리에 관한 가이드라인을 발표했다.
|
올해부터 임상시험용 의약품 최신 안전성 정보(DSUR)를 보고하는 과정이 신약부터 단계적으로 확대될 전망이다. 임상시험기관은 의약품 등의 안전에 관한 규칙(총리령) 개정 추진 방향에 따라 임상시험에 대한 포괄적인 안전성 정보를 분석, 평가한 내용을 제출해야 한다.
또한 올해부터 임상연구윤리센터의 범위를 넓혀 기존 기존의 코로나19 치료제·백신 및 항암제 분야에 한정됐던 범위를 전체 임상시험 범위로 확대해 나갈 전망이다. 또한 소규모 공동심사시스템을 활용하는 과정에서 임상학회와 협업해 분야별 전문가 자문단으로 구성된 심사과정으로 개편된다. 전문성을 강화하기 위해 다기관 통합심사 전산시스템 구축하여 23년에는 전격적으로 가동할 예정이다.
임상시험대상자의 권익보호를 위해 국가적 차원에서 실시되는 지원 체계도 마련된다. 올해부터 임상시험대상자 지원센터가 운영되면서 의사를 비롯한 의료 전문인력을 배치해 국내 임상시험의 신뢰 기반을 확대할 전망이다.
이를 제도적으로 뒷받침하기 위해 임상시험 검체분석 관리기준을 제정을 추진해 국제 수준의 분석결과를 내놓도록 임상 환경을 조성한다. 현행 비임상시험 관리기준에서 검체분석 관련 조항을 분리하고 임상시험 특성을 반영해 별도 관리기준을 마련한다.
한편, 지난 해까지 시행된 임상시험 기관 관리 기준에 따르면 자율점검기관은 자율점검계획 수립 및 이행, IRB 조치사항 이행여부, 자율점검 점검자의 자격 기준 여부를, 정기실태조사기관은 HRPP,AAHRPP 및 헬프데스크 운영 여부, 시설, 인력, 임상연구윤리센터(IRB) 등의 기준으로 평가돼왔다.
전체댓글 0개
등록된 댓글이 없습니다.
오늘의 헤드라인
-
01 "알테오젠 이을 신흥강자 떴다" 판 흔드는 ... -
02 메디컬에이아이 '의료 AI' 국가전략기술 확인 -
03 "과학자 2700명 모였다" 한국분자·세포생물... -
04 GC녹십자 창립 58주년, ”도전 정신으로 미래... -
05 싸토리우스, 10월 '바이오 DSP 심포지엄' 개... -
06 K-바이오랩허브사업추진단, 첨단재생의료산... -
07 SK바이오사이언스, 영유아 RSV 예방 항체주... -
08 셀트리온, UEGW 2025서 ‘램시마SC’ 장기 임... -
09 알리코제약, '알듀카정' 앞세워 650억 고... -
10 SK바이오팜, 역대 최대 실적 기틀 마련 미국...











