뉴스
동일 제조소 제네릭 '묶음형' 허가관리로 변경
식약처 제도개선…완제의약품 허가 시 원료등록 병행
박선혜 기자 │ loveloveslee@yakup.com


입력 2020-05-13 11:16 수정 2020.05.13 11:50
식약처가 제네릭의약품 관리개선을 위해 동일 제조소 제네릭을 '묶음형' 허가관리로 변경한다.

|
이번 조치는 '제네릭의약품 국제 경쟁력 제고'의 일환으로 제네릭의약품 품질심사 절차를 효율화하기 위한 것으로, 동일제조소 제네릭의약품을 묶음형으로 허가관리하고 품질심사 검토 조직을 식품의약품안전평가원으로 일원화하는 등 개선한다.
제네릭 '묶음형 허가'는 1개 제조소에서 제조되는 다수 업체의 제네릭은 제품명만 다를 뿐 제조소·원료·제조방법·생동자료 및 품질이 동일한 품목인 만큼, 일관성 있는 자료요건 등 허가·관리기준을 마련하고 이를 통일적으로 적용한다는 개념이다.
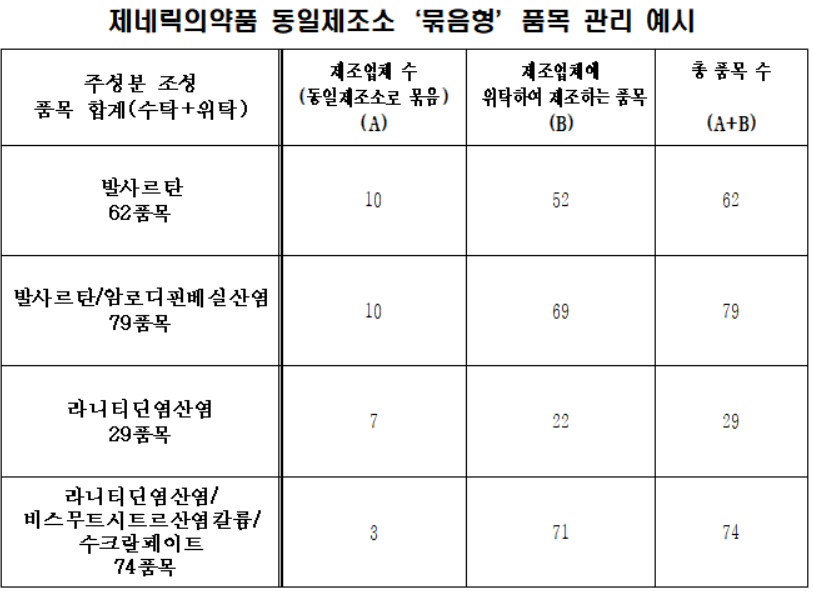
|
식품의약품안전평가원이 총괄해 품목제조업자(수탁사)의 품목을 심사하면 이와 생동성자료까지 동일한 위탁제조품목에 대해서 각 지방청은 이 품질심사 결과에 따라 허가하게 되는 절차로 간소화된다.
식약처는 이에 대해 "심사기간이 단축되고, 그동안 각 지방청별로 심사해 발생한 눈높이 차이가 상당 부분 해소될 것"이라고 기대효과를 밝혔다.
또한 제네릭의약품 허가 신청자료로서 제출한 국제공통기술문서(CTD) 검토 시 원료의약품 등록심사를 병행하는 것으로 개선·추진한다.
완제의약품 심사 시 원료의약품의 불순물, 유연물질 등을 같이 검토할 수 있어 심사단계에서 NDMA 사례와 같은 위험요인을 종합적으로 파악하고 불순물 검출 예방에 더욱 효과적일 것으로 기대된다.
제네릭의약품 성분을 정해 시범적으로 운영하고 개선효과에 대해 평가를 거쳐 점진적으로 확대할 예정이다.
식약처는 "오늘(13일)부터 시행되는 이번 개선조치를 통해 제네릭의약품의 품질수준을 높여 국민들의 신뢰확보에 기여할 수 있기를 기대한다"며 "이번 조치로 인한 허가신청 접수 및 처리기간 등 기타 변동은 없다"고 밝혔다.
전체댓글 0개
등록된 댓글이 없습니다.
오늘의 헤드라인
-
01 바이오노트,CTC바이오 추가 지분 인수... ... -
02 옙바이오, KDDF 심포지엄서 글로벌 빅파마와... -
03 VNTC "미국 이노비스와 척추측만증 교정기 '... -
04 에이비엘바이오, 독성 한계 극복 '4-1BB 단... -
05 이노크라스-STREAM 컨소시엄, 이건희 소아암... -
06 압타머사이언스, 신약개발 기업과 압타머 발... -
07 대한약사회, 30일 ‘한약사 문제 해결’ 대정... -
08 미국, 10월 1일부터 의약품 100% 관세 부과.... -
09 콜마비앤에이치 사내이사로 윤상현·이승화 선임 -
10 아이넥스 'ENAD CADx',대장내시경 AI 분야 ...











