뉴스
지난해 새로운 제형 의약품 개발 증가…시밀러도 상승추세
식약처, 2019년 의약품 허가현황 보고서 발표
박선혜 기자 │ loveloveslee@yakup.com


입력 2020-04-28 10:39 수정 2020.04.28 14:47
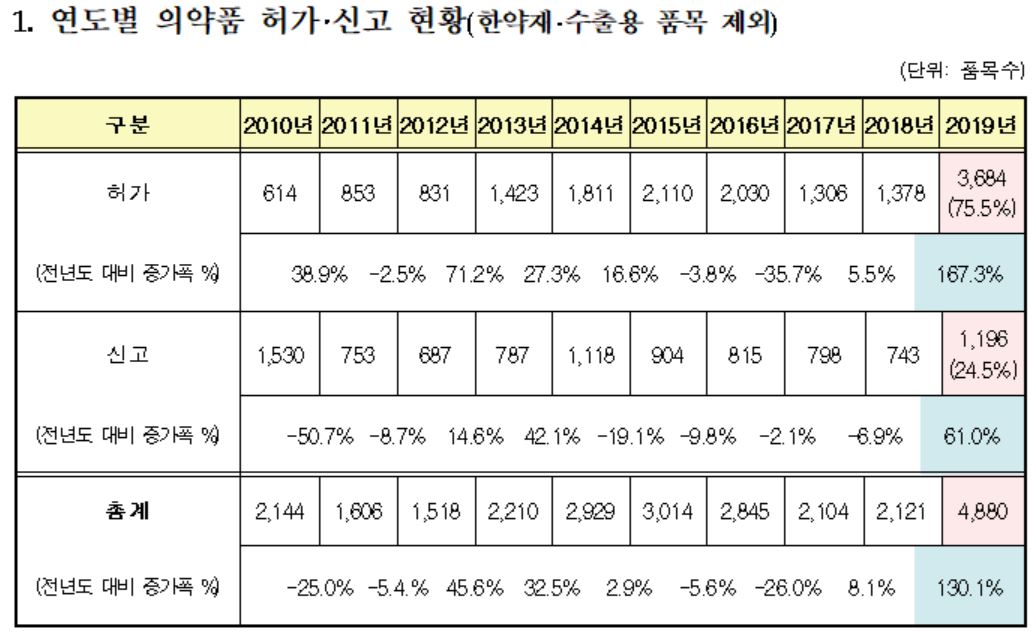
식품의약품안전처(처장 이의경)는 지난해 의약품 허가·신고 현황을 담은 ‘2019년 의약품 허가 보고서’를 28일 발간했다.
지난해 의약품 허가‧신고 현황 주요 특징은 △새로운 제형 형태 제품개발 증가 △국내 개발 개량신약 및 바이오시밀러 개발 상승 추세 △ 신경계용의약품의 강세 등이다.
|
|
새로운 제형 등 개발 증가
지난해 새로운 제형(71개 품목, 38.8%)의 국내 개발이 두드러졌는데, 기존의 ‘캡슐제’를 정제 등 다른 ‘경구용 제제’로 개발하거나 ‘현탁용 분말’을 ‘산제’로 개발한 경우가 많았으며, 특히, ‘일반(속방성)제제’를 약의 복용 횟수를 줄여 편의성을 높인 ‘서방성제제’로 개발한 경우가 강세를 보였다.
한편, 특허 회피 전략 등으로 활용되는 ‘새로운 염’ 또는 ‘이성체’ 의약품(2개 품목, 1.1%) 개발은 큰 폭으로 감소했는데(2018년대비 91.7% 감소), 이는 특허 회피 전략 필요성 감소와 식약처의 개량신약 불인정 등의 영향으로 분석된다.
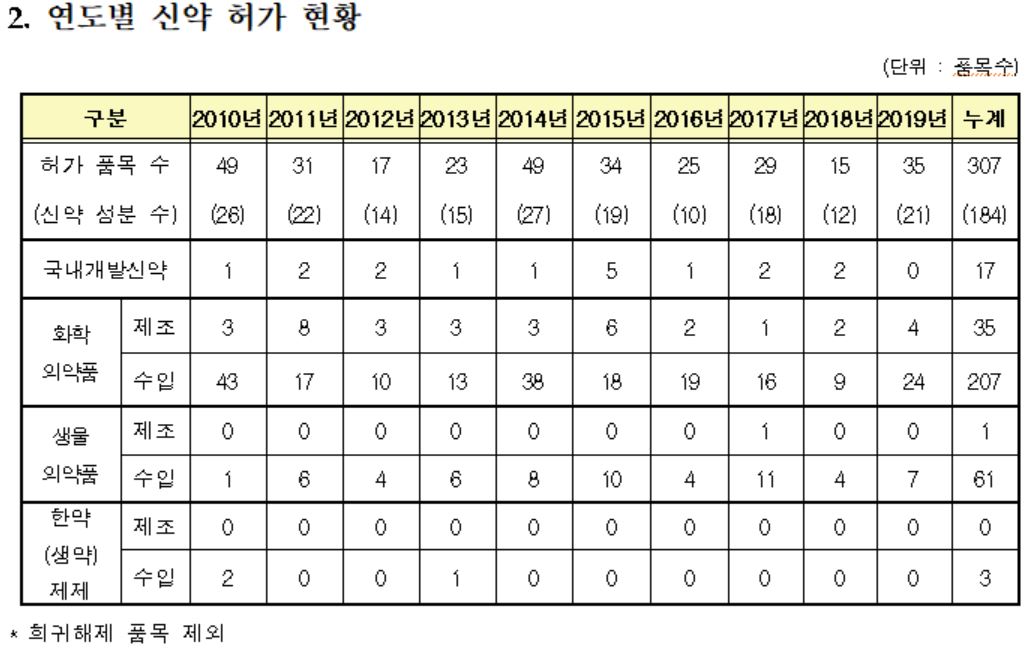
국내 개발 개량신약·바이오시밀러 개발 지속
신약은 35개 품목이 허가됐으며, 이 중 국내 신약은 4개 품목, 수입 신약은 31개 품목으로, 제품 특성별로는 화학의약품 28개 품목, 생물의약품 7개 품목이다.
신약 허가는 전년 대비 증가했고, 국내 개발 개량신약과 바이오시밀러도 꾸준히 개발되고 있는 것으로 나타났다.
신약은 2017년 28개·17성분, 2018년 15개·12성분, 2019년 35개·21성분으로 지속적 증가를 보였으며 국내개발 개량신약은 2017년 11개·4성분, 2018년 6개·1성분, 2019년 13개·11성분으로 확인됐다.
국내개발 바이오시밀러의 경우 2017년 2개·2성분 2018년 7개·2성분, 2019년 3개·2성분으로 작년에 비해 감소 추세를 보였다.
화학의약품 신약 중 국내(4개 품목)는 전이성 결장직장암 치료와 파킨슨 증후군 치료제 각 2개 품목, 생물의약품 신약의 경우 모두 수입(7개 품목)으로 백혈병치료제, 골다공증치료제 등이 허가됐다.
‘신경계용의약품’이 가장 많이 허가
약효군별로 분류하면 해열·진통·소염제 등이 포함된 ‘신경계용의약품’이 1,070개 품목(22.2%)으로 가장 많이 허가됐는데, 이는 18년(19.5%) 대비 약 2.7% 증가한 것으로, 해열 또는 진통제와 치매치료제 등 중추신경용약의 지속적인 증가에 따른 것으로 분석된다.
신경계용의약품에 이어 혈압강하제 등 ‘순환계용의약품’ 902개 품목(18.8%), ‘소화 기관용의약품’ 545개 품목(11.3%), ‘기타의 대사성의약품’ 및 ‘당뇨병용제’ 437개 품목(9.1%), ‘항생물질제제’ 267개 품목(5.6%), ‘화학요법제’ 251개 품목(5.2%), ‘혈액 및 체액용약’ 230개 품목(4.8%), ‘알레르기용약’ 207개 품목(4.3%) 등의 순으로 나타났다.
식약처는 "국내 의약품 연구·개발에 도움을 주기 위해 매년 ‘의약품 허가보고서’를 발간하고 있다"며 "앞으로도 국내 의약품 허가·신고 현황과 분석 정보를 지속적으로 제공하다"고 전했다.
전체댓글 0개
등록된 댓글이 없습니다.
오늘의 헤드라인
-
01 바이오노트,CTC바이오 추가 지분 인수... ... -
02 옙바이오, KDDF 심포지엄서 글로벌 빅파마와... -
03 VNTC "미국 이노비스와 척추측만증 교정기 '... -
04 에이비엘바이오, 독성 한계 극복 '4-1BB 단... -
05 이노크라스-STREAM 컨소시엄, 이건희 소아암... -
06 압타머사이언스, 신약개발 기업과 압타머 발... -
07 대한약사회, 30일 ‘한약사 문제 해결’ 대정... -
08 미국, 10월 1일부터 의약품 100% 관세 부과.... -
09 콜마비앤에이치 사내이사로 윤상현·이승화 선임 -
10 아이넥스 'ENAD CADx',대장내시경 AI 분야 ...











