뉴스
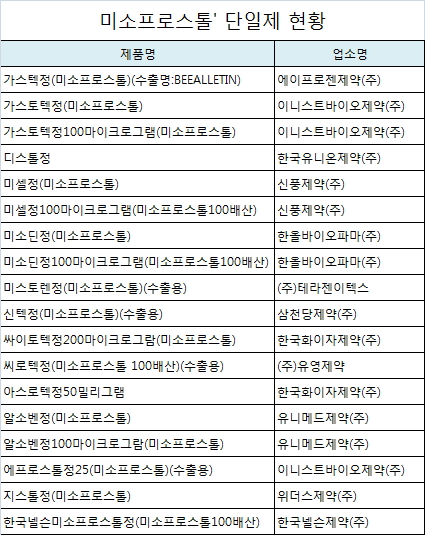
소화성 궤양용제 '미소프로스톨' 단일제 18품목 허가사항 변경
임신 첫 삼분기 노출시 기형발생위험 대조군에 비해 3배 이상 증가
김용주 기자 │ yjkim@yakup.com


입력 2019-02-13 12:00 수정 2019.02.13 12:02
|
식품의약품안전처는 유럽 의약품청(EMA)의 '미소프로스톨' 함유제제 관련 안전성 정보에 대한 검토결과에 따라 12개 업체 18품목의 허가사항 변경을 추진한다고 밝혔다.
허가사항 변경은 임부 및 수유부에 대한 투여시 "임신 첫 삼분기에 미소프로스톨에 노출되면 기형 위험이 대조군에서 2% 확률로 발생한 것에 비해 3배 증가한다. 특히, 이 약에 태아가 노출되면 뫼비우스 증후군(사지 결손 유무와 관계없이, 선천성 안면 마비로 인한 표정감소, 빨기, 연하 및 눈의 움직임 어려움), 양막띠 증후군(사지기형, 절단, 특히 만곡족, 지부족증, 손결여증, 구개열 등) 및 중앙신경계 이상(무뇌증, 뇌수종, 소뇌저형성, 신경관 결함과 같은 대뇌 및 두개골 이상)과 관련이 있다. 따라서 이 약을 투여받은 여성은 최기형성의 위험에 대해 숙지되어야 하며, 태아가 미소프로스톨에 노출된 이후 환자가 임신을 지속시키기를 원한다면, 사지와 머리에 특별한 주의를 기울여 초음파로 모니터링을 해야한다"는 내용이 추가된다.
전체댓글 0개
등록된 댓글이 없습니다.
오늘의 헤드라인
-
01 서울에 모인 한·중 제약바이오 리더들…"전략... -
02 "유전체데이터 혁신 앞장" NDS, 'AWS 퍼블릭... -
03 디티앤씨알오, '대한민국 일자리 으뜸기업' ... -
04 해외 의약품 제조소, 미국 FDA ‘기습 불시 ... -
05 아리바이오, 저주파 음향진동 전자약 기술 S... -
06 케어젠, 튀르키예 ‘아타바이’ 와 펩타이드 ... -
07 국내 연구진, 줄기세포 기반 인공혈액 대량... -
08 UNICEF “전세계 비만아동 최초 저체중아 추월” -
09 헐리우드와 빅파마 만남…줄리안 무어-릴리 ... -
10 MoCRA 제대로 모르면 낭패, 선케어 미국 수...











