뉴스
개발단계 희귀의약품으로 지정받은 품목은?
식약처, 2013년 도입후 18개 지정 …개발 성공율 높이기 위해 지원 강화
김용주 기자 │ yjkim@yakup.com


입력 2018-08-09 06:15 수정 2018.08.09 09:39
|
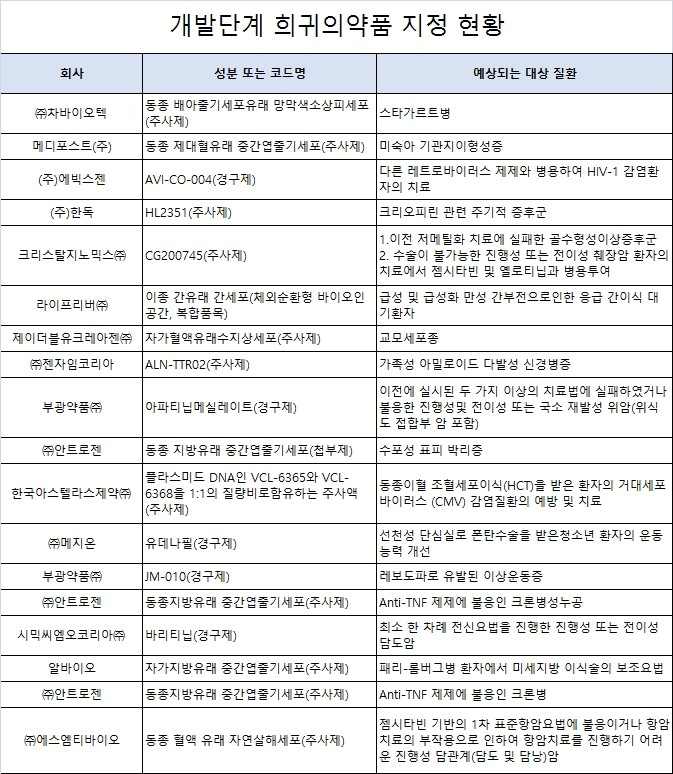
지난 2013년 도입된 개발단계 희귀의약품 제도에 따라 그동안 총 18개 품목이 지정을 받은 것으로 집계됐다.
식품의약품안전처는 지난 2013년 개발단계에서 미리 희귀의약품으로 지정해 허가 자료 요건 등의 예측 가능성을 높이고 희귀 의약품 개발 성공률을 높이기 위해 '개발단계 희귀의약품 지정제ʼ를 도입 시행중이다.
그동안 식약처로부터 개발단계 희귀 의약품으로 지정받은 성분은 총 18개로 나타났다.
차바이오텍의 스타가르트병치료제 '동종 배아줄기세포유래 망막색소상피세포(주사제)'를 비롯해 에스엠티바이오의 진행형 담관계암 치료제 '동종 혈액 유래 자연살해세포(주사제)' 등 18개 품목이다.
희귀의약품은 적은 환자수, 채산성 등의 문제로 그동안 연구개발을 기피하는 경향이었으나, 희귀질환의 원인 규명 노력과 각국의 개발지원 정책 추진으로 세계시장 선점 가능성이 높은 분야로 급부상하고 있다.
희귀의약품은 판매가격이 높고, 상대적으로 개발비가 적게 들어 수익성이 일반 신약에 비해 높다는 평가를 받고 있다.
식약처는 블루오션 시장으로 각광받고 있는 희귀의약품 개발을 유도하기 위해 △희귀의약품 품목허가 유효기간 연장(5년→10년) △희귀의약품 재심사 기간을 10년 이내로 부여해 자료보호를 통한 개발의욕 고취 △희귀의약품 제조 및 품질관리기준(GMP) 평가 자료 요건 완화 △희귀의약품 지정 시 시장규모 제한 기준 폐지 △희귀의약품 사전검토 수수료 면제 등을 시행하고 있다.
전체댓글 0개
등록된 댓글이 없습니다.
오늘의 헤드라인
-
01 심천당제약, 아일리아 바이오시밀러 '비젠프... -
02 한국유나이티드제약 창립 38주년 "지속 투자... -
03 제6회 희귀유전질환 심포지엄, 벡스코 개막…... -
04 정부·기관·기업 합심해 미국 관세 파고 넘는다 -
05 동화약품, 2025 가송 예술상 시상식... 김미... -
06 국민 10명 중 9명 “편의점 안전상비약 품목 ... -
07 현대바이오USA, 미국 MCDC 정회원 공식 승인 -
08 제이엘케이, 뇌경색 중증도 AI 자동 분석 논... -
09 갤럭스 "AI로 세상에 없던 항체 설계 성공" -
10 롯데바이오로직스, 하반기 글로벌 바이오 행...











