뉴스
개정된 제네릭 등재 절차, 주의사항은?
판매 예정일 3개월 이전 결정신청, 우선판매품목 30~60일 조속평가
최재경 기자 │ cjk0304@yakup.com


입력 2015-08-27 17:30 수정 2015.08.28 10:40
제네릭 의약품의 급여 등재 시, 판매 예정일을 반드시 표기하고 판매 예정일을 포함한 3개월 이전에 등재 결정신청을 해야한다.
27일 건강보험심사평가원(원장 손명세) 은 가등재 폐지 및 허가특허연계제도 관련 등재절차 설명회를 개최, 제약사 및 관련 업계 관계자를 대상으로 제도 변경에 따른 세부 내용을 안내했다.
이날 설명회는 지난 7월 7일 개정된 '약가의 결정 및 조정 기준' 개정안에 포함된 내용으로 즉시 판매 가능한 의약품만이 등재할 수 있다는 내용을 골자로 한다.
이날 설명회는 지난 7월 7일 개정된 '약가의 결정 및 조정 기준' 개정안에 포함된 내용으로 즉시 판매 가능한 의약품만이 등재할 수 있다는 내용을 골자로 한다.
판매 여부와 상관 없이 미리 등재가 가능한 가등재제도가 폐지되고, 즉시 판매가 가능한 의약품만 등재신청이 가능해 지는 것.
제약사는 식약처 품목허가 후, 등재 소요 기간을 고려해 판매 예정일이 포함된 월 기준으로 최대 3월 이전부터 결정 신청을 해야한다. 제네릭의 등재 시행시기는 매월 1일과 제약사 제출 판매예정일이며 월기준으로 안내되는 기존의 방식은 동일하다.
제약사는 식약처 품목허가 후, 등재 소요 기간을 고려해 판매 예정일이 포함된 월 기준으로 최대 3월 이전부터 결정 신청을 해야한다. 제네릭의 등재 시행시기는 매월 1일과 제약사 제출 판매예정일이며 월기준으로 안내되는 기존의 방식은 동일하다.
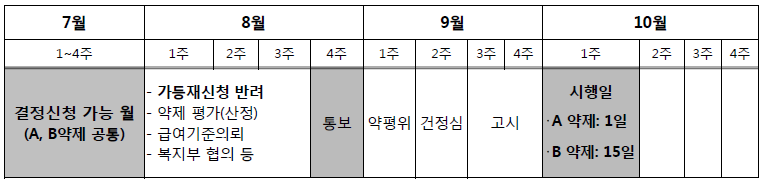
예를 들어 10월 1일 판매 가능한 제네릭 A와 10월 15일 판매 가능한 제네릭 B가 등재 신청을 한 경우, A와 B 모두 7월 결정신청이 가능하다. 10월 판매 예정인 품목의 결정 신청을 8월에 할 경우 가등재 신청은 반려된다.
|
8월에는 약제평가(산정)와 급여기준의뢰, 복지부 협의 등이 진행되며 마지막 주 제약사에 검토결과를 통보한다. 9월에는 약평위와 건정심을 거쳐 마지막주 고시되며 10월에 각각의 판매 예정 시기에 맞춰 급여가 시행된다.
결정신청은 심평원 홈페이지에서 가능하며 등재 후 즉시 또는 판매 예정일을 입력하지 않은 경우 결정 신청이 불가능하다.
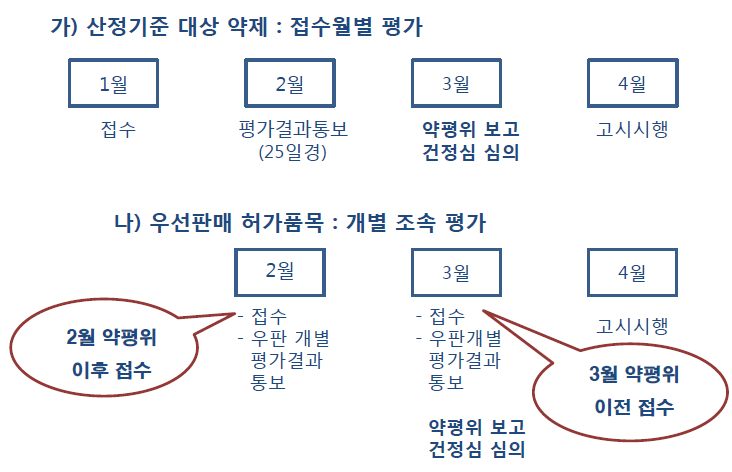
또한, 허가특허연계제도에 따른 우선판매허가품목에 대해서는 '조속평가'를 실시해 등재 일정을 줄였다.
|
또한, 허가특허연계제도에 따른 우선판매허가품목에 대해서는 '조속평가'를 실시해 등재 일정을 줄였다.
우선판매허가품목은 별도 검토과정으로 신속 실무 검토를 거쳐 가장 빠른 약평위에 상정되는데 결정신청, 신속실무검토, 제약사 통보, 약평위 보고까지의 등재 쇼요기간이 60~90일에서 30~60일로 단축된다.
우선판매 확인은 결정신청시 식약처 공문 첨가 및 우선판매를 증명하는 자료를 서면제출해야 한다. 현재 우선판매허가품목은 고혈압 복합제로 20개 제약사 41개 품목이 등록돼 있다.
결정신청 시 주의해야 할 점은 주성분 함량과 규격단위, 함량별 신청, 품목기준코드, 주성분 코드 등의 표기사항을 정확히 기입해야 한다. 주성분 코드가 없을 시 공란으로 비워놓아야 한다.
만약 비슷한 것을 표기한 경우 그 품목의 제네릭으로 인지하는 오류가 생길수 있다
또, 판매 예정가를 포장단위별, 최소단위별로 확인해야 하며, 약가와 기타 약제 정보 확인에 따른 평가결과 통보사항에 대해 제약사가 '수용' 버튼을 10일내로 눌러야 인정된다.
결정신청 접수 후 변경 사항(판매 예정가나 제품명 등)은 반드시 담당자와 유선으로 연락해야 한다.
또한, 우선판매품목 결정신청 시 식약처 공문 및 허가조건 사항을 반드시 제출해야 하고, 식약처 허가 조건 등 변경 시 관련 자료를 제출하고 담당자에게 유선 연락을 해야 한다.
전체댓글 0개
등록된 댓글이 없습니다.
오늘의 헤드라인
-
01 "ADC 넘을 모달리티 나왔다" 오름테라퓨틱, ... -
02 2025년 비급여 693항목 공개…같은 진료 최대... -
03 셀트리온, ‘아이덴젤트’ 52주 임상서 유효성... -
04 '2025 LSK Global PS, 창립 25주년 기념 심... -
05 코아스템켐온, 미국 재생의학연구소 WFIRM과... -
06 한국비엔씨, 진메디신과 장기지속형 비만치... -
07 인트론바이오,'SAL200' 수술전 처치 약물 임... -
08 아이엠비디엑스, 액체생검 새 시대 연다..환... -
09 퓨쳐켐, 전립선암 치료제 FC705 美 임상 2a... -
10 아미코젠, 기존 특허 장벽 돌파 차세대 인간...











