SC 제형 우선 출시로 시장 선점 가속화… 차별화한 주사제로 투여 편의성·안전성 확대
1년 만에 바이오의약품 포트폴리오 두 배로 확대… 바이오시밀러 분야서 큰 성장 이룰 전망

|
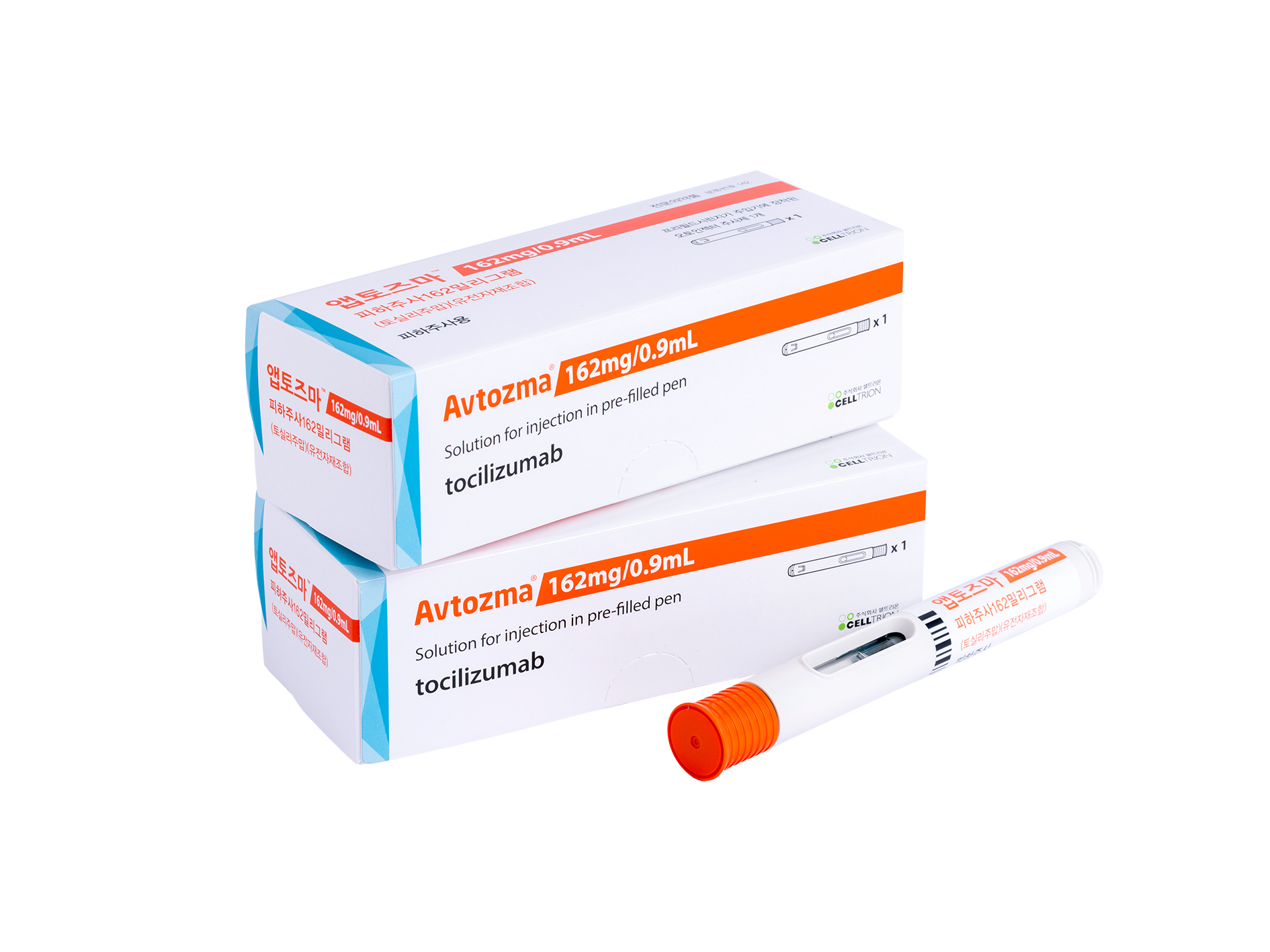
셀트리온제약은 자가면역질환 치료제 악템라(성분명 토실리주맙) 바이오시밀러 ‘앱토즈마’의 국내 판매를 개시한다고 2일 밝혔다.
앱토즈마는 체내 염증 유발에 관여하는 인터루킨(IL)-6 단백질을 억제해 염증을 감소시키는 인터루킨 억제제다. 류마티스 관절염(RA), 전신형 소아 특발성 관절염(sJIA), 다관절형 소아 특발성 관절염(pJIA) 등에 대한 적응증을 갖고 있으며, 국내 시장 규모는 약 200억원으로 추산된다.
개발사인 셀트리온이 류마티스 관절염 환자 총 471명을 대상으로 진행한 앱토즈마(프로젝트: CT-P47) 글로벌 임상 3상 연구에 따르면, 앱토즈마는 오리지널 의약품 대비 사전에 정의한 동등성 기준에 맞아 유효성, 동등성, 약동학 및 안전성을 확인했다.
이 같은 임상 결과 등을 토대로 셀트리온은 지난 1월과 2월 미국, 유럽에서 잇따라 앱토즈마의 품목허가를 획득하고, 국내에서도 지난해 12월 정맥주사(IV) 제형 ‘앱토즈마주’를 국내 첫 토실리주맙 성분 바이오시밀러로 허가받아 ‘퍼스트무버(First Mover)’ 지위를 확보한 바 있다.
아울러 올해 2월에는 피하주사(SC) 제형인 ‘앱토즈마피하주사(162mg)’의 품목허가를 획득, 셀트리온제약이 24만 5,938원으로 약가 등재 과정을 거쳐 이달 국내에 출시하며 경쟁 바이오시밀러 대비 시장을 선점할 수 있게 됐다.
특히 이번에 출시한 앱토즈마피하주사(Autoinjector, 자동주사제형)는 기존 제품 대비 한층 개선된 주사기 설계를 적용해 투여 편의성과 안전성을 강화한 것이 특징이다. 기존 경쟁제품은 외부 투약 버튼을 눌러 약물을 주입하는 반면, 앱토즈마피하주사는 피부면에 주사기를 누르면 바로 약물 투여가 가능하다.
이를 통해 투여 과정에서 주사 각도가 틀어지는 등 문제로 약물이 손실될 수 있는 우려를 해결했다. 또한 별도의 안정성 시험을 거쳐 사용기한을 제조일부터 36개월까지 확대했다. 이는 경쟁 제품의 사용기간 24개월 대비 12개월가량 늘어난 수치다.
셀트리온제약은 이번 SC 제형의 빠른 출시로 경쟁 우위를 확보하고 환자들의 치료 접근성을 높이기 위해 최선을 다하는 한편, 시장점유율 확대를 위해 의료진을 대상으로 설명회를 진행할 계획이다. 아울러 향후 의료진이 환자의 상태와 편의를 고려해 선택적으로 처방할 수 있도록 올해 안에 정맥주사(IV) 제형인 앱토즈마주(80mg, 200mg, 400mg)도 출시할 예정이다.
이번 제품을 포함해 셀트리온제약이 국내에 판매 중인 바이오시밀러 제품군은 지난해 8월 비전2030 선포 당시 6개(램시마, 램시마SC, 트룩시마, 허쥬마, 유플라이마, 베그젤마)에서 최근 6개(스토보클로, 오센벨트, 아이덴젤트, 스테키마, 옴리클로, 앱토즈마)가 증가, 현재 총 12개 제품에 달하고 있다. 불과 일 년 만에 기존에 판매하던 제품의 두 배만큼 제품 포트폴리오를 확대함에 따라 향후 바이오시밀러 분야에서 높은 매출 증가가 이뤄질 전망이다.
셀트리온제약 관계자는 “앱토즈마는 강화된 편의성과 퍼스트무버의 이점을 바탕으로 국내 시장을 빠르게 공략해 시장에 조속히 안착할 것”이라며 “올해 제품 포트폴리오를 대폭 확대하며 바이오시밀러 부문에서 큰 성장을 이룰 전망”이라고 말했다.
-
01 이뮨온시아, CD47 타깃 면역항암제 임상1b상... -
02 바이오톡스텍, 소속부 중견기업부로 변경 -
03 오스코텍,차세대 항암신약 'OCT-598' 미국 F... -
04 에임드바이오, 511억원 규모 Pre-IPO 투자 ... -
05 유바이오로직스, 2공장 WHO PQ 승인…"유비콜... -
06 올리브영, 한국로지스틱스대상 2개 부문 수... -
07 한국비엔씨, " 로포라사, 2세대 우울증 신약... -
08 K-화장품 규제외교 선도, ‘2025 원아시아 화... -
09 한국얀센 "유통 마진 개별 협상" VS 의약품... -
10 슬록, 코스모뷰티서울 '클린뷰티2.0 네트워...











