뉴스
씨드모젠 "'AAV 백터' 신약개발 핫이슈…안전성 연구·규제 고도화 필요"
럭스터나·졸겐스마 성공으로 AAV 활용 증가세…임상서 안전성 문제 지속 제기
권혁진 기자 │ hjkwon@yakup.com


입력 2022-10-17 06:00 수정 2022.11.08 23:00
“유전자치료제는 현대의약학의 한계를 근본적으로 해결할 수 있다는 점이 증명되면서 전 세계적으로 주목받고 있다. 현재 글로벌 빅파마의 기술거래와 M&A 대상에서 단연 일순위로 꼽히고 있고, FDA 임상시험 신청도 기하급수적으로 증가하고 있다. 이에 국내에서도 바이러스벡터 고도화에 주목할 필요가 있다.”
씨드모젠 박기랑 대표는 지난 14일 식품의약품안전평가원이 개최한 '2022 첨단바이오의약품 규제과학 콘퍼런스'에 참가해, AAV(아데노부속바이러스) 기반 첨단바이오의약품의 글로벌 동향과 관련 기술의 중요성에 대해 이같이 강조했다.
씨드모젠 박기랑 대표는 지난 14일 식품의약품안전평가원이 개최한 '2022 첨단바이오의약품 규제과학 콘퍼런스'에 참가해, AAV(아데노부속바이러스) 기반 첨단바이오의약품의 글로벌 동향과 관련 기술의 중요성에 대해 이같이 강조했다.

|
▲씨드모젠 박기랑 대표가 '첨단바이오의약품 연구개발 동향 및 사례' 세션에서 발표하고 있다.(사진=권혁지 기자)
씨드모젠은 바이러스 기반 유전자치료제 신약개발 기업이다. 지난 2009년부터 유전자치료제의 각종 바이러스벡터 GMP 제조 서비스를 제공하고 있고, 2012년부터는 바이러스벡터 특이적인 테스팅 서비스도 확장하며, 바이러스 기반 백신과 유전자치료제 CDMO 사업을 진행 중이다.
박 대표는 “지난 2012년 AAV1-hlPL 벡터 기반의 글리베라(Glybera)의 EMA 최초 승인을 시작으로, 현재까지 AAV와 Lentivirus(렌티바이터스) 바이러스벡터 기반 치료제가 여러 건 승인됐다"라며 "특히 최근에는 AAV 기반의 럭스터나와 졸겐스마, 렌티바이러스 기반의 킴리아와 예스카타 등이 전 세계 환자에게 활발하게 사용되며, 바이러스벡터 기술은 자리를 잡아가는 추세”라고 전했다.
이어 “이에 따라 최근 글로벌 신약개발 비즈니스 트렌드는 AAV 기반 플랫폼 기술과 이를 기반으로 한 신약개발 전문기업이 주도하는 모습”이라며 “실제 지난 2020년에는 바이엘이 AAV의 우수한 기술력을 보유한 애스크바이오(AskBIo)를 40억 달러(5조7700억 원) 규모에 인수하는 빅딜이 성사됐다”고 강조했다.
또한 해당 거래뿐만 아니라 지난 2019년에는 로슈가 AAV 기반 유전자치료제 럭스터나를 개발한 스파크 테라퓨틱스(Spark Therapeutics)를 43억 달러(2조2천억 원) 규모에 인수하는 빅딜도 이뤄졌다.

|
▲씨드모젠 박기랑 대표.(사진=권혁진 기자)
박 대표는 또한 최근 AAV 기반 유전자치료제 성공 사례로 해당 분야가 활성화되고 있지만, AAV의 한계점도 드러나고 있어, 관련 기술에 대한 연구개발과 규제에도 신경 써야 한다는 의견을 제시했다.
그는 “전 세계에서 개발 중인 유전자치료제 약 24%가 AAV를 기반으로 할만큼, AAV는 널리 활용되고 있다. 그러나 지난 2021년 FDA에서 발표한 자료에 따르면, 관련 임상시험 중 약 35%에서 TESAEs(임상시험에서 투여 후 발생한 중대한 이상반응)가 발견되는 것으로 나타났다”라며 “이는 인간의 면역반응이 매우 복잡하고 계속 진화하기 때문”이라고 설명했다.
이어 “최근 규제기관들이 환자 안전성을 위해 바이러스 벡터에 대해 더 엄격하게 검토함에 따라, AAV 면역 메커니즘과 속성에 관한 연구 및 AAV를 정확히 평가할 수 있는 약리 독성시험, 특히 임상시험 안전성 평가에 더 주의를 기울여야 한다"라며 “국내 식약처에서도 이러한 상황을 고려한 규제 방향을 선제적으로 설정할 필요가 있다”고 덧붙였다.
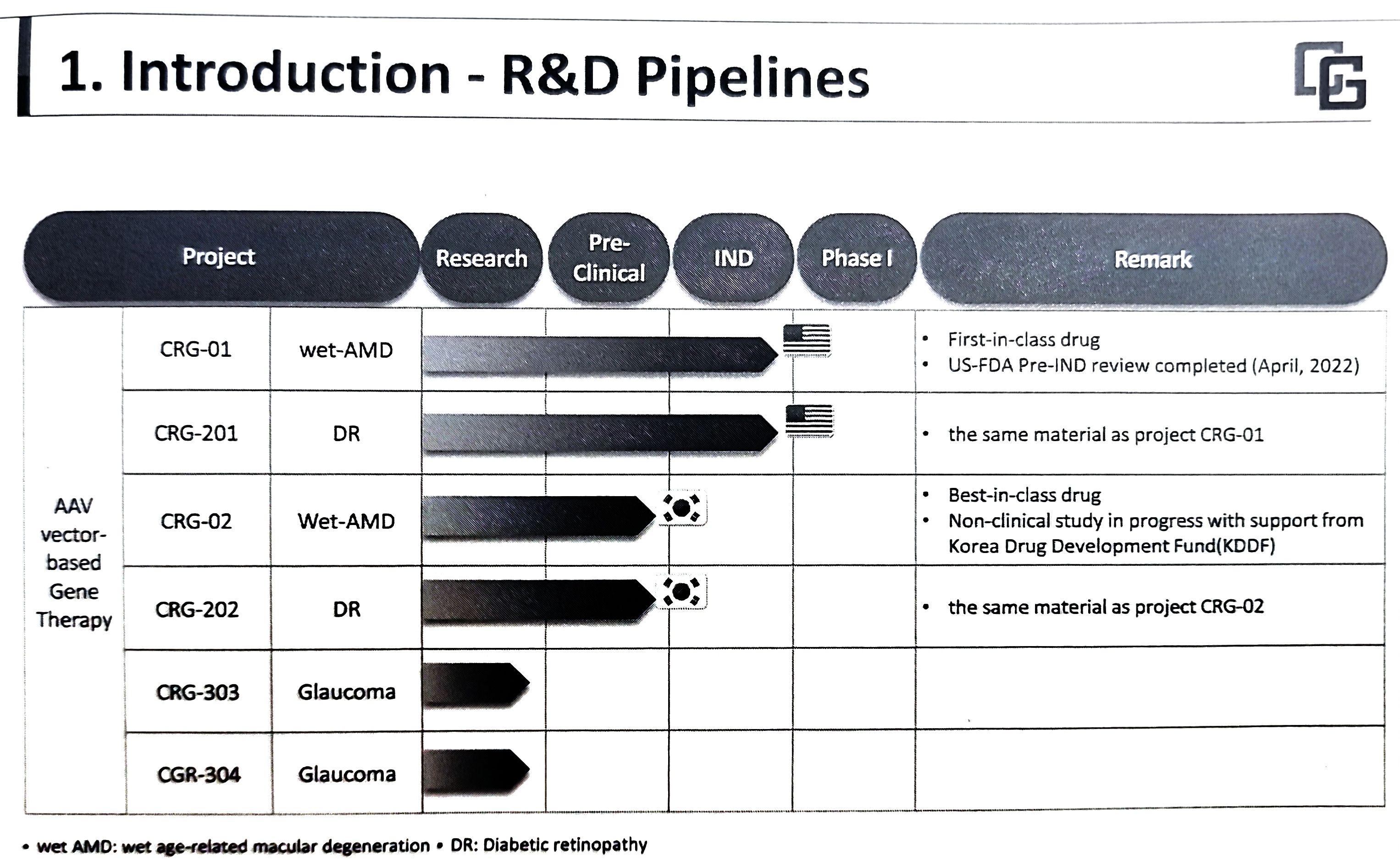
|
▲씨드모젠 연구개발 파이프라인.(출처: 박기랑 대표 발표자료 스캔)
한편 씨드모젠은 지난 7월 큐로진생명과학과 합병했으며, 현재 AAV 백터 기반의 유전자치료제 파이프라인 6개를 구축해 연구개발하고 있다. 가장 선두에 있는 'CRG-01'은 습성황반변성을 적응증으로 하며, 미국에서 임상시험을 진행하기 위해 지난 4월 FDA와 사전 IND 미팅을 완료하고, IND 신청을 진행하고 있다.
전체댓글 0개
등록된 댓글이 없습니다.
오늘의 헤드라인
-
01 한국콜마, 세계적 화학기업 '바스프' 손잡... -
02 '2000억원' 규모 26년 국가신약개발사업 스... -
03 대한약사회, 건보공단 특사경 도입 '찬성'…... -
04 대한약사회, 대웅제약에 '블록형 거점도매 ... -
05 한올바이오, 오송 특화공장 신축 투자 중단 -
06 한국유니온제약,M&A 공고...'스토킹호스' 방... -
07 IVI-질병관리청, 팬데믹 대응 임상시험검체... -
08 GC녹십자, 코로나19 mRNA 백신 국내 임상 1... -
09 마이크로디지탈, 셀트리온 생산공정에 ‘더... -
10 디앤디파마텍, “FDA의 AI 기반 MASH 조직 분...











