뉴스
코로나19 치료제 임상 17건 진행 중…'약물재창출 8건' 주목
임상 3상 신풍제약·대웅제약·종근당…경구용 제제 11건·주사제 5건
항바이러스제 약물재창출 연구 활발…현대바이오 구충제로 연구 중
항바이러스제 약물재창출 연구 활발…현대바이오 구충제로 연구 중
권혁진 기자 │ hjkwon@yakup.com


입력 2021-12-31 06:00 수정 2022.01.01 11:10
코로나19 치료제로 긴급사용승인받은 화이자의 팍스로비드(Paxlovid) 중 '리토나비르(Ritonavir)'는 약물의 재창출을 통해 HIV(후천성면역결핍증) 치료제부터 코로나19 치료제까지 사용 범위를 넓혔다. 이에 따라 국내에서도 항바이러스제를 이용한 약물재창출 임상시험에 관심이 집중되고 있다.
한국제약바이오협회는 지난 24일 `국내 코로나19 치료제 및 백신 개발 현황`을 파마인포데스크를 통해 게재했다.
|
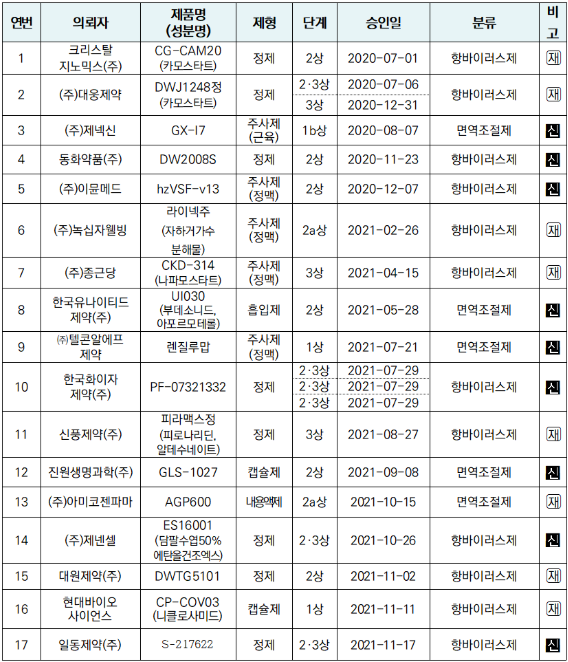
한국제약바이오협회 데이터에 따르면 현재 국내에서는 17개 기업에서 코로나19 치료제 임상시험을 진행하고 있는 것으로 나타났다.
팍스로비드(니르마트렐비르, 리토나비르)와 같은 제형인 ▲정제(알약)는 8건으로 나타났으며, 투여방식이 동일한 ▲캡슐제는 2건 ▲내용액제(현탁액 및 시럽)는 1건으로 나타났다.
아울러 정식으로 품목허가 된 셀트리온의 렉키로나주(레그단비맙)와 같은 ▲주사제형은 5건(정맥 4건, 근육 1건)로 나타났으며, 기타 ▲흡입제형은 1건으로 나타났다.
임상 3상을 승인받은 기업은 ▲신풍제약 ▲대웅제약 ▲종근당이며, 3사는 임상시험 대상자를 모집하고 있는 것으로 확인됐다.
임상 2·3상을 승인받은 기업은 ▲일동제약 ▲제넨셀 ▲한국화이자제약이며, 임상 2상 승인 기업은 ▲대원제약 ▲아미코젠파마 ▲진원생명과학 ▲한국유나이티드제약 ▲녹집사웰빙 ▲이뮨메드 ▲동화약품 ▲크리스탈지노믹스로 나타났다.
임상 1상 승인 기업은 ▲현대바이오사이언스 ▲텔콘알에프제약 ▲제넥신으로 나타났다.
이 중 새로운 물질은 9개로 확인됐으며, 국내에서 다른 효과로 허가받은 의약품을 코로나19 치료제로 약물재창출 하는 경우는 8개로 나타났다.
신물질에 해당하는 항목은 ▲일동제약(항바이러스제) ▲제넨셀(항바이러스제) ▲진원생명과학(면역조절제) ▲한국화이자제약(항바이러스제) ▲텔콘알에프제약(면역조절제) ▲한국유나이티드제약(면역조절제) ▲이뮨메드(항바이러스제) ▲동화약품(항바이러스제) ▲제넥신(면역조절제)이다.
`약물재창출`에 해당하는 항목은 ▲현대바이오사이언스(항바이러스제) ▲대원제약(항바이러스제) ▲아미코젠파마(면역조절제) ▲신풍제약(항바이러스제) ▲종근당(항바이러스제) ▲녹십자웰빙(항바이러스제) ▲대웅제약(항바이러스제) ▲크리스탈지노믹스(항바이러스제)다.
한편 화이자가 긴급사용승인을 받은 팍스로비드는 `니르마트렐비르 2정`과 `리토나비르 1정`을 함께 복용해야 한다. 이중 리토나비르(Ritonavir)는 애브비(AbbVie)에서 후천성면역결핍증 치료제(항바이러스제)로 이미 시판돼 사용 중인 제품이다. 아울러 국내에서도 지난 2011년 허가돼 `노비르정`으로 판매 중이다.
이에 따라 기존 시판 중인 항바이러스제의 약물재창출 연구가 더 활발해지는 양상이다.
지난 7일 현대바이오(현대바이오 사이언스)는 기자간담회를 통해 항바이러스제의 약물재창출로 코로나19 경구 치료제를 개발 중이라고 발표한 바 있다.
현대바이오에서 개발하고 있는 코로나19 치료제는 `CP-COV03(니클로사마이드, Niclosamide)'으로 기존 구충제로 사용되고 있다. 또한 우수한 항바이러스 효과를 비롯해 오랜 기간 사용 중인 제품임으로 안전성이 높다고 평가되고 있다.
특히 해당 기자간담회에서 진근우 연구소장은 “덴마크 유니온테라퓨틱스와 유럽 주요 대학의 연구 결과에서 코로나19 Wuhan(우한)타입과 박쥐에서 채취한 바이러스, 알파, 베타, 델타 바이러스에 변이와 상관없이 항바이러스 효능이 입증됐다”라며 "과학적 기반의 데이터를 기반으로 니클로사마이드를 선정했다"고 밝혔다. 이에 치료제 개발 기대감이 더 높아지고 있다.
또한 대웅제약도 니클로사마이드의 생체이용률을 증가시킨 주사제형의 코로나19 개량신약 `DWRX2003`을 개발하고 있으며, 한국파스퇴르연구소도 함께 연구 중이다. 아울러 대웅제약은 카모스타트(항바이러스제, Camostat Mesylate)를 이용해 코로나19 치료제 임상시험도 진행하고 있다.
한편 식품의약품안전처에서는 지난 1월 코로나19 백신과 치료제 개발을 지원하기 위해 고강도 신속 제품화 촉진 프로그램인 `고(GO)-신속 프로그램`을 도입했다.
이를 통해 약물재창출인 경우 7일 이내, 신약은 15일 이내에 심사를 완료하고 임상시험을 승인 할 것이라고 밝혔다.
이를 통해 약물재창출인 경우 7일 이내, 신약은 15일 이내에 심사를 완료하고 임상시험을 승인 할 것이라고 밝혔다.
[관련기사]
코로나19 의약품 지출 298조 전망…비코로나 제품 위축
2021-12-29 06:00
전체댓글 0개
등록된 댓글이 없습니다.
오늘의 헤드라인
-
01 퍼슨헬스케어-주빅, 마이크로니들 기반 PN ... -
02 휴젤, 2025년 매출 14%↑ 4251억-영업익 21.3... -
03 유한양행, 매출 5.7%↑ 2조1866억원-영업이익... -
04 정부, 화장품산업육성법 제정 근거 마련 나선다 -
05 이투바이오,기술기업 3사 전략 제휴 체결...... -
06 알테오젠, 설립 첫 현금배당 단행…200억원 ... -
07 유유제약, '고양이 바이오 신약'으로 승부수... -
08 한국비엔씨,"지속형 비만치료제,마운자로 동... -
09 이뮨온시아, 1200억 규모 유증..‘글로벌 면... -
10 엘리시젠, 바이오젠 출신 신약개발 전략 전...











