뉴스
유전자 CRISPR 특허 경쟁…CAR-T cell 개발까지 가능
'제 13회 GCCW 2021' CRISPR 이용한 신약 개발 플랫폼 소개…자체 개발 특허 기술 확보
김상은 기자 │ kims@yakup.com


입력 2021-11-23 06:00 수정 2021.11.23 14:46
유전자를 편집하는 CRISPR 기술이 항암제 개발 분야까지 정복하고 나서 특허 경쟁이 예고된다.
카이스트 글로벌 기술사업화 센터(GCC)에서 주최하는 제 13회 GCCW(Global Cmmercialization and Workshop; GCCW)에서 22일 최지원 지플러스 사이언스(G+FLAS Life Sciences Inc) CTO는 ‘차세대 CRISPR 유전자가위 개발과 이의 활용’을 주제로 CRISPR 신약 개발 플랫폼에 대한 전망을 소개했다.

|
CRISPR 유전자 가위는 2020년 노벨 화학상 수상을 계기로 글로벌 제약·바이오 분야에서 화두로 떠올랐다. 유전자가위 기술은 1세대 징크 핑거 뉴클레아제 그 뒤에 2세대 탈렌(TALEN)에 이어 현재는 3세대 CRISPR 유전자 가위로 이어지고 있다.
대표적으로 CRISPR/Cas9는 절단 효율이 높아 가장 각광받고 있는 유전자 가위다. Cas9 유전자 가위는 매우 설계가 간편하고 이전에 비해서 제작 비용이 저렴하고 정교하고 편집기술력을 가진다. 편집기술이 향상된 유전자 가위는 소량만 투입해도 표적 이탈 가능성을 크게 낮춘다.
최 CTO는 “지플러스 생명과학에서 이 CRISPR/Cas9을 보다 한 단계 업그레이드해 CRISPR PLUS라는 차세대 유전자 가위를 내놨다”고 설명했다. Cas9에 비해 짧은 gRNA로 구성된 CRISPR PLUS는 편집 효율 면에서 기존에 비해 최대 10배 증가한 데다 정확도도 크게 향상됐다.
지플러스에서 자체적으로 개발한 gfCas12a는 Cas9인이 자르지 못하는 유전자 부위까지 절단할 수 있으며 DNA 이중가닥 구조에서 서로 다른 위치를 절단할 수 있는 특이점을 가진다.
최 CTO는 “DNA가 가지는 복구 시스템의 특징을 이용해서 타깃으로 삼은 유전자가 소위 말해서 ‘knock out' 하여 성능적으로 더 이상 작동하지 못하도록 조절하여 질병을 치료하는 기전을 활용한다”고 설명했다.
최지원 CTO는 “유전자가위로 DNA를 절단하면 손상된 DNA가 회복하려는 성질로 끊어진 DNA끼리 연결되는 비상동말단연결(NHEJ) 내지는 새로운 DNA 염기서열이 삽입되는 상동직접수선(HDR)이 일어난다”며 “특정 타깃 유전자를 절단해서 정교하게 복구되지 못하도록 하여 염기서열의 삽입이나 삭제를 일으킬 수 있도록 CRISPR 유전자를 설정했다”고 말했다.
CRISPR9 유전자 가위가 DNA의 특정 염기서열에 착지해 유전자를 정교하게 절단할 수 있도록 Cas9 단백질에 여러 퓨전 약물을 첨가해 절단 효율을 높이려 했다. Cas9 유전자에 모듈레이터 및 다른 염기서열을 첨가해 CRISPR PLUS를 만들어냈다.
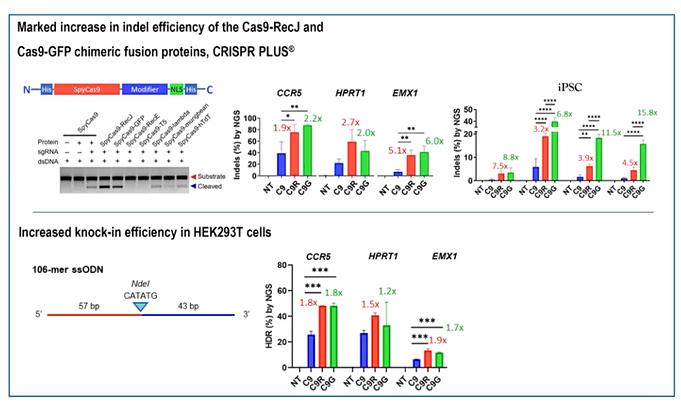
|
최 CTO는 “이 유전자 가위를 CCR5나 HPRT1, iPSC와 같은 다양한 유전자를 편집하는 데에 적용시켜 본 결과 기존의 Cas9에 비해서 추가적으로 덧붙인 퓨전 요소들로 인해 편집효율이 최소 2배에서 많게는 15.8배까지 늘어난 것을 확인할 수 있었다”고 부연했다. 더불어 특정 유전자를 삽입하는 ‘knock in’의 효율성도 기존의 Cas9에 비해 2배 정도 늘었다는 것이 최지원 CTO의 설명이다.
Case 유전자 가위는 정확한 DNA의 염기서열 부위를 절단해야 하기 때문에 유사한 염기서열과 혼동되지 않도록 타깃을 구별하는 민감도도 중요한데, 최 CTO는 “유전자 가위의 온타깃(on target)의 효율은 올라가고 아웃 타깃(out target)은 저조한 형태로 보였다”고 설명했다.
또한 체외 상에서 이 gfCas12a만이 가지고 있는 특징 중 하나는 부수적 핵산 분해효소 민감도(collateral DNase acitivity)의 감소다. 즉, DNA가 절단될 때 단발성에 그치는 것이 아니라 연쇄반응처럼 염기서열을 계속 절단하는 현상인데, 이러한 불필요한 절단 현상을 크게 감소시켰다는 얘기다.
▶암세포의 특이적 염기서열 편집해 내는 CRISPR, 항암 신약 플랫폼으로 자리매김
CRISPR 항암신약 플랫폼(Cancerase)는 암 특이적 돌연변이를 타깃으로 삼는 gRNA 기반 Cas 기반 단백질 복합조성물이다. 암세포의 특이적 염기서열에 gRNA-Cas9이 이중가닥을 절단해서 암 DNA를 손상시켜 암세포의 사멸을 유도하는 것이다.
최 CTO는 “Cancerase는 정상세포에는 존재하지 않는 암세포의 염기서열만 구별해내어 유전자가위로 절단해서 80%의 세포를 사멸시켰다”며 “이러한 CRISPR 기반 혁신 항암제는 두경부암(또는 자궁경부암)의 원인 유전자로 지목되는 HPV+유전자 중에서도 암세포를 발현시키는 특정 타깃 E6 내지 E7을 편집해내는 목적으로 설계됐다.‘고 설명했다. 이 항암물질(SCC-47)을 주입했을 때 자궁경부암 세포주에서 50% 이상의 사멸 효과를 확인할 수 있었다.
즉, Cas9만 발현하게 했을 때 NT5에서보다는 HPV E6 또는 E7을 각각 타깃으로 삼는 sgRNA도 같이 발현하는 시험군의 세포사멸 능력이 우월한 것이 증명된 것이다. 궁극적으로는 사람의 암 환자에다가 딜리버리 하는 양식을 지금 많이 개발을 하고 있다.
▶범용 가능한(Off the shelf) 동종의(Allogeneic) CAR-T cell 개발
유전자 가위를 활용한다면 기존에 CAR-T cell을 개발하는 자가(Autologous) 세포치료의 한계나 높은 개발비용을 극복할 수 있는 가능성이 있다. 다만 동종의 CAR-T cell을 개발하는 것에는 이식편대숙주질환(GVHD; graft-versus-host disease)이란 큰 장벽이 존재하고 있다.
그러나 GVHD에 해당하는 유전자를 제거하면 어떻게 될까? 건강한 피세포 공여자로부터 받은 T-cell을 동종의 T-cell로 발전시킬 수 있다.
최 CTO는 “연구진은 CRISPR 가위를 사용해 TRAC과 β2M을 knock out 시켜 CD3 및 HLA-ABC 단백질의 발현을 막는 T-cell을 개발했고 결과적으로 이러한 동종의 T-cell 개발 단계까지 시도하고 있는 상황이다”라고 말했다. 그는 덧붙여 “이외에도 knock out 타깃으로 고려되는 PD-(L1)와 같은 물질을 기준으로 면역관문억제제를 개발하는 방식으로 파이프라인의 개발 방향은 무궁무진하다”고 평했다.
현재 미국과 스위스의 여러 회사에서는 유전질환을 타깃을 하는 다양한 유전자 가위를 개발하고 있다고 언급하며, “CRISPR 기술 외에도 유전자를 절단하지 않고 편집하는 Beam Therapeutics나 Prime Medicine에 대한 연구개발도 이어갈 전망”이라고 전했다.
전체댓글 0개
등록된 댓글이 없습니다.
오늘의 헤드라인
-
01 유니셀랩, 뉴로바이오젠 치매·비만 신약 '티... -
02 유한양행, 창립 99주년... '100년 기업 향한... -
03 에스티큐브, 전이성 대장암 ‘넬마스토바트’ ... -
04 대한간호조무사협회, 보건복지부로부터 '법... -
05 휴온스, 30억원 규모 자기주식취득 신탁계약... -
06 제약·바이오·건기식 비즈니스 장 'CPHI bioL... -
07 파미셀, 아반트릭스와 '첨단재생의료' 힘 합... -
08 큐로셀,‘안발셀’ 최종 임상2상서 장기 생존... -
09 알지노믹스, 항암 유전자치료제 'RZ-001' 국... -
10 코스맥스엔비티, '밀배유 추출물'로 피부 2...











