뉴스
유럽 체외진단의료기기 IVDR 시행 코앞…코로나 진단키트는?
강화된 체외진단의료기기 규칙 시행으로 약 8,726개, 22% 시장 퇴출 예상
유럽진출 활발한 국내 코로나19진단키트 기업도 피해 가능성↑
유럽진출 활발한 국내 코로나19진단키트 기업도 피해 가능성↑
권혁진 기자 │ hjkwon@yakup.com


입력 2021-09-27 06:00 수정 2021.09.27 06:04
유럽의 체외진단의료기기에 관한 규제가 대폭 변경될 예정이다. 현재 국내의 코로나19 진단키트 기업이 유럽진출을 활발하게 하고있어, 신속한 대응이 필요하다는 전망이다.
기존 체외진단의료기기 지침(IVDD 98/79/EC, In Vitro Diagnostic Medical Devices Directive) 보다 엄격한 요구사항을 포함한 체외진단의료기기 규칙(IVDR 2017/746 EU, The In Vitro Diagnostic Medical Devices Regulation)이 지난 17년 5월 제정돼, 5년의 유예기간을 거쳐 오는 22년 5월 26일부터 시행될 예정이다.
|
현행에서는 일부 체외진단의료기기는 유럽 인증기관의 적합성 평가를 받지 않고 자가적합성 선언 후 시판되고 있지만, 개정된 'IVDR'에 따르면, 현재 시판중인 체외진단의료기기의 등급분류가 달라지고 유럽 인증기관의 적합성 평가를 반드시 수행해야 한다.
또한 의료기기에 대한 사전허가, 인증기관 지정 및 감독을 위한 기준 강화, 새로운 등급분류 체계의 도입이 이뤄질 전망이다.
코로나19 진단키트의 'IVDR'에 따른 등급은 ▲전염성 물질의 존재 및 노출 감지 ▲전파 위험성이 높고, 생명을 위협하는 질병의 전염성 물질의 존재 및 노출 감지 ▲환자 관리 과정에서 모니터링이 중요한 생명을 위협하는 질병의 감염 여부 측정에 해당돼 D Class로 분류될 것이라고 알려져 있다.
이에 따라 코로나19 진단키트의 유럽 수출을 위해선 해당하는 등급에 적합한 요구사항을 충족시켜야 하므로 허가 준비에 상당한 시간이 소요될 예정이다. 또 허가 심사 과정의 기간도 기존 대비 배 이상으로 늘어날 것으로 예상돼, 유럽 체외진단의료기기 시장의 선점을 위해선 신속한 준비가 필요하다는 지적이다.
이에 따라 코로나19 진단키트의 유럽 수출을 위해선 해당하는 등급에 적합한 요구사항을 충족시켜야 하므로 허가 준비에 상당한 시간이 소요될 예정이다. 또 허가 심사 과정의 기간도 기존 대비 배 이상으로 늘어날 것으로 예상돼, 유럽 체외진단의료기기 시장의 선점을 위해선 신속한 준비가 필요하다는 지적이다.
현재 영국과 덴마크를 필두로 프랑스, 독일, 스웨덴, 핀란드, 아일랜드 등이 '위드코로나'로 방역 지침을 변경하면서 실시간으로 코로나19 진단이 가능한 진단키트의 수요가 대폭 증가할 것으로 전망돼, 국내 코로나19 진단키트 기업의 유럽 시장 진출의 활로가 열렸다는 평가가 나오고 있다.
한국바이오협회는 `유럽 체외진단업계 내년 새로운 규제법 시행에 무방비` 보고서 발간을 통해 유럽의료기술산업협회가 유럽 체외진단 시장의 90%를 점유하는 업계를 대상으로 새로운 체외진단의료기기 규제법(IVDR) 준비상황에 대해 설문조사를 실시한 결과를 제시했다.
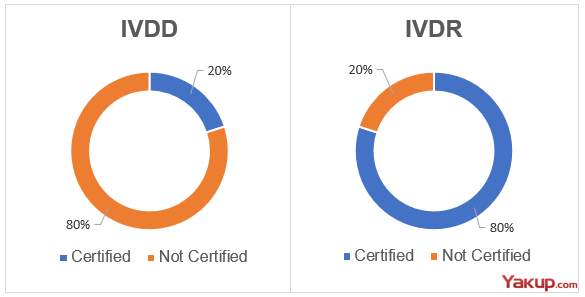
보고서에 따르면 현행 'IVDD' 하에 시장에서 유통되는 3만9,844개의 기기 중 3만1,118개만 새로운 'IVDR' 으로 이전 등록할 계획이다.
또한 강화된 규정으로 인해 전체의 약 22%인 8,726개의 체외진단의료기기는 유럽 시장에서 사라질 것으로 예상된다. 특히 대기업은 2만4,769개에서 2만459개로 17.4% 감소하는 반면, 중소기업은 1만5,075개에서 1만659개로 29.3% 감소할 것으로 집계돼 중소기업에서 더 큰 타격을 입을 것으로 예상된다.
아울러 현행 'IVDD' 하에서는 전체 체외진단의료기기 3만9,844개의 8%인 3,302개가 인증이 필요하고, 나머지 92%는 인증이 필요 없었다. 그러나 새로운 'IVDR' 하에서는 전체 인증 대상 3만1,118개의 78%인 2만4,346개가 인증이 필요할 것으로 예측돼 현행 'IVDD' 대비 737% 폭증할 것으로 추산된다.
현재까지 새로운 'IVDR' 에 따라 인증받은 체외진단의료기기는 2,878개며, 인증이 필요 없는 Class A 6,782개를 더하면 총 9,660개인 24%가 최소한 시장에 남을 것으로 전망된다.
그러나 새로운 'IVDR' 에 충족하기 위해 더 많은 체외진단의료기기가 인증을 받아야 하지만, 현재까지 6개 인증기관만 지정받아 시행까지 8개월만 남은 시점에서 허가의 지체가 필연적으로 따라올 것으로 예상된다. 현행 'IVDD' 하에서의 지정된 인증기관은 18개로 3배 이상 모자란 수치다.
또한 응답 기업의 53%는 인증기관과 계약이 이뤄지지 않은 상황이며, 계약됐다고 응답한 기업도 모든 체외진단기기를 제시간에 인증받을지 장담하기 어려운 상황이라고 전했다.
한국바이오협회는 “체외진단의료기기의 규제법 시행에 따라 국내 기업이 인증기관과 조속한 접촉을 통해 규제변화에 대응해야 한다”라고 밝혔다.
[관련기사]
유럽 임상시험 등록시스템 전면 변화…유럽 30개국 동시 신청
2021-09-13 06:00
전체댓글 0개
등록된 댓글이 없습니다.
오늘의 헤드라인
-
01 유니셀랩, 뉴로바이오젠 치매·비만 신약 '티... -
02 유한양행, 창립 99주년... '100년 기업 향한... -
03 에스티큐브, 전이성 대장암 ‘넬마스토바트’ ... -
04 대한간호조무사협회, 보건복지부로부터 '법... -
05 휴온스, 30억원 규모 자기주식취득 신탁계약... -
06 제약·바이오·건기식 비즈니스 장 'CPHI bioL... -
07 파미셀, 아반트릭스와 '첨단재생의료' 힘 합... -
08 큐로셀,‘안발셀’ 최종 임상2상서 장기 생존... -
09 알지노믹스, 항암 유전자치료제 'RZ-001' 국... -
10 코스맥스엔비티, '밀배유 추출물'로 피부 2...











