뉴스
췌장암 항암치료제 ‘오니바이드주’, 보험급여 신규 적용
심평원, 20일 ‘암환자에게 처방‧투여하는 약제 공고 개정’ 의견조회 공고
이주영 기자 │ jylee@yakup.com


입력 2021-07-21 06:00 수정 2021.07.21 14:58

|
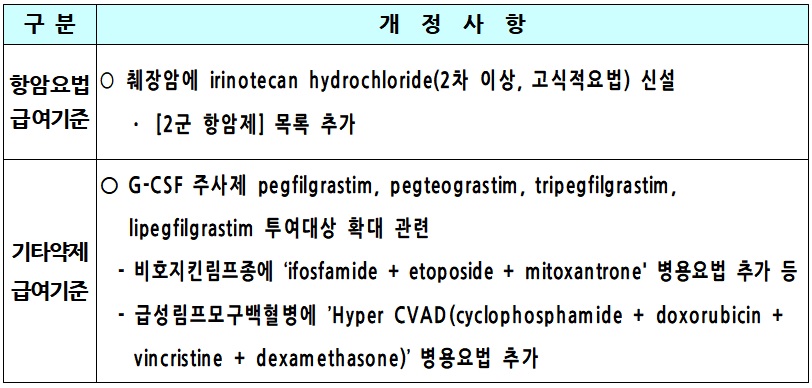
건강보험심사평가원은 20일 췌장암 항암요법인 이리노테칸염산염(2차 이상, 고식적요법)에 요양급여를 적용하기 위해 오는 26일까지 의견을 조회한다고 밝혔다.
심평원에 따르면 이번 공고 개정에 따라 췌장암의 고식적요법 2차 투여단계 이상에서 ‘리조포말 이리노테칸(liposomal irinotecan)+플루오로우라실(fluorouracil)+류코보린(leucovorin)’ 항암요법에 대해 급여기준을 적용할 예정이다. 투여대상은 젬시타빈(gemcitabine) 기반 항암요법 이후 진행된 전이성의 경우이며, 단 ECOG 수행능력평가가 0 또는 1인 경우에 한한다.
심평원은 공고 사유에 대해 “이리노테칸염산염(품명: 오니바이드주(나노리포좀이리노테칸)’은 ‘젬시타빈을 기반으로 하는 항암요법 이후 진행된 환자에 대한 플루오로우라실 및 류코보린과 병용한 전이성 췌장암의 치료’에 허가받은 약제”라며 “교과서·가이드라인·임상논문 등을 참조해 검토한 결과, 교과서에서 해당 요법이 언급되며 NCCN 가이드라인에서 이전에 젬시타빈 기반 치료를 받은 good performance status인 전이성 췌장암의 2차 치료에 category 1로, ESMO 가이드라인에서 (II, B)로 권고되고 있다”고 설명했다.
이어 “18세 이상의 전이성 췌장암 환자를 대상으로 한 무작위 배정 공개 3상 임상시험(NAPOLI-1)에서 해당 요법과 ‘5-FU +류코보린’ 병용요법을 비교한 결과, 전체생존기간 중앙값(mOS) 6.1개월 vs. 4.2개월(HR 0.67, 95% CI 0.49-0.92; p=0.012), 무진행생존기간 중앙값(mPFS) 3.1개월 vs. 1.5개월(HR 0.56, 95% CI 0.41-0.75; p=0.0001)로 확인돼 임상적 유용성이 입증됐다”고 덧붙였다.
다만 심평원은 “투여대상을 good performance status인 환자로 제한할 필요가 있으므로 전문가 의견 등을 고려해 ECOG 수행능력평가 0 또는 1인 환자로 제한해 급여기준을 설정했다”고 전했다.
|
또한 심평원은 G-CSF 주사제의 페그필그라스팀(pegfilgrastim, 품명: 뉴라스타프리필드시린지주), 페그테오그라스팀(pegteograstim, 품명: 뉴라펙프리필드시린지주), 트리페그필그라스팀(tripegfilgrastim, 품명: 유라스틴주사액프리필드시린지), 리페그필그라스팀(lipegfilgrastim, 품명: 롱퀵스프리필드주)의 투여대상을 확대한다고 밝혔다.
이에 따라 비호지킨림프종에 ‘이포스파미드(ifosfamide)+에토포시드(etoposide)+미토산트론(mitoxantrone)’ 병용요법이 추가된다.
급성림프모구백혈병에는 Hyper CVAD 항암요법인 ‘시클로포스파미드(cyclophosphamide) + 독소루비신(doxorubicin) + 빈크리스틴(vincristine) + 덱사메타손(dexamethasone)’ 병용요법이 추가된다.
이에 대해 심평원은 “G-CSF 주사제 중 지속작용 제제인 ‘페그필그라스팀’은 악성 종양에 대한 세포독성 화학요법을 투여받는 환자의 발열성 호중구감소증의 발생과 호중구감소의 기간을 감소한다”며 “페그테오그라스팀, 트리페그필그라스팀, 리페그필그라스팀은 ‘고형암 및 악성 림프종에 대한 세포독성 화학요법을 투여받는 환자의 중증 호중구 감소증 기간 감소’에 각각 허가받은 약제로, 만 19세 이상 암환자에서 급여기준에 명시된 일부 임종 및 항암요법에 한해 함께 투여하는 경우 급여인정되고 있다”고 설명했다.
이어 “이에 건강보험 보장성 강화 정책의 일환으로 추진 중인 기준비급여의 급여화 정책과 관련, 현재 전액 본인부담으로 사용 중인 범위에 대해 급여기준 확대 여부를 검토한다”고 덧붙였다.
또한 심평원은 “교과서·가이드라인·학회의견 등을 참조해 검토한 결과, 교과서에서 항암요법의 지지치료 관련 발열성 호중구감소증 발생률이 20% 정도인 세포독성 화학요법을 시행하는 환자에게 1차 예방 G-CSF가 투여된다고 언급하며, NCCN 가이드라인에서 발열성 호중구감소증의 위험성이 20% 초과인 항암화학요법을 시행하는 경우 G-CSF 주사제 투여를 권고하고(category 1), 위험성이 10%-20%인 경우 환자의 위험요인에 근거해 G-CSF 주사제 투여를 고려할 수 있다고 언급했다(category 2)”고 전했다.
이에 “가이드라인 등에서 추가로 권고한 항암화학요법 중 임상적 필요도, 학회 및 임상전문가 의견, 실제 임상에서 발생하는 발열성 호중구 감소증 위험성 등을 고려해, ‘발열성 호중구감소증의 위험성이 20% 초과’로 확인되는 요법인 비호지킨림프종에서 Hyper CVAD, R-hyper CVAD, 이포스파미드+에토포시드+미토산트론 요법, 급성림프모구백혈병에 Hyper CVAD 요법을 발열성 호중구감소증 위험도 20% 초과에 급여 적용키로 했다”고 밝혔다.
이에 “가이드라인 등에서 추가로 권고한 항암화학요법 중 임상적 필요도, 학회 및 임상전문가 의견, 실제 임상에서 발생하는 발열성 호중구 감소증 위험성 등을 고려해, ‘발열성 호중구감소증의 위험성이 20% 초과’로 확인되는 요법인 비호지킨림프종에서 Hyper CVAD, R-hyper CVAD, 이포스파미드+에토포시드+미토산트론 요법, 급성림프모구백혈병에 Hyper CVAD 요법을 발열성 호중구감소증 위험도 20% 초과에 급여 적용키로 했다”고 밝혔다.
다만 심평원은 “‘페그테오그라스팀, 트리페그필그라스팀, 리페그필그라스팀’의 경우 급성림프모구백혈병에 허가돼 있지 않지만, G-CSF 주사제는 호중구 감소증 발생을 예방하는 약제로 암종별 명확한 효과 차이가 나타나지 않으며, 해당 급여기준은 관련 가이드라인에 근거해 설정하는 점 등을 고려, G-CSF 주사제 모두에 급여기준을 적용하고자 한다”고 부연했다.
이같은 공고 개정은 다음달 1일 시행될 예정이다. 이는 ‘국민건강보험법’ 제41조 제2항 및 ‘국민건강보험 요양급여의 기준에 관한 규칙’ 제5조 제4항 규정에 의한 조치다.
전체댓글 0개
등록된 댓글이 없습니다.
오늘의 헤드라인
-
01 한국줄기세포학회, ‘차광렬 학술상’ 제정 -
02 종근당,'텔미누보정' 본태성 고혈압 개량신... -
03 '랩오토메이션 강자' 큐리오시스, 증권신고... -
04 대한약사회, 유니온약품 불법 리베이트 사건... -
05 삼천당제약, 상반기 매출 성장에도 영업손실... -
06 "비임상시험, 단순 자료 아닌 전략적 자산…... -
07 "심평원, 성인 신경섬유종 환자 외면…소아 ... -
08 오송첨단의료산업진흥재단 센터장, 성비위 ... -
09 JW중외제약,상반기 매출 6.7%-영업익 24%↑..... -
10 동아ST, 그래디언트 바이오컨버전스와 신약...











