뉴스
마이크로바이옴 잘만 활용하면 ‘면역조절’ 치료 가능?
KASBP 추계학술대회 발표 ‘iNKT 피노타입 추적‥마이크로바이옴 대사물질이 면역조절인자’
김상은 기자 │ kims@yakup.com


입력 2021-11-15 06:00 수정 2021.11.15 15:31
최근 마이크로바이옴을 중심으로 이뤄지는 인간의 생리학·병리학적 기전의 인과관계에 대한 연구가 활발하게 진행되면서 마이크로바이오타가 대사 및 면역질환에 대한 치료 대안으로 떠오르고 있다.

|
재미한인제약인협회(KASBP)가 주최한 2021년 KASBP 가을 심포지엄에서 지난 12일 Brigham and Women’s hospital의 오성환 박사는 ‘Mining metabolites from microbiota’라는 주제로 발표에 임했다.
현재 마이크로바이옴 연구에서 논의되는 내용 중 하나는 박테리아가 보내는 신호가 숙주(인간)에 인지되고 이로 인해 면역조절반응이 이뤄진다는 것이다. 오성환 박사는 “통제군과 질병군을 비교함으로써 피노타입의 유무에 따라 물질대사의 흐름이 어떻게 달라지는지, 이러한 물질대사를 생산하는 생물학적 인자들을 찾아내어 생체(in vivo) 모델을 고안해내는 단계까지 연구를 진행한다”고 말했다.
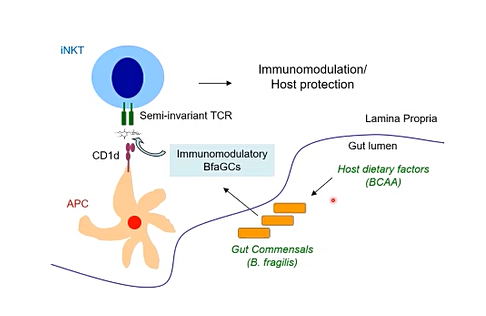
오 박사는 면역 시스템을 조절하는 마이크로바이오 인자들에 대한 연구 내용을 소개하며 박테리아의 대사물질이 면역조절인자로 작동한다는 사실을 전했다. 오성환 박사는 “최근 연구에서 특정 T-cell 피노 타입을 발견했는데, 이를 'iNKT(natural killer Tcell)'이라고 명명했다. 무균 쥐에서는 iNKT cell의 반응이 치솟았는데 여기에는 면역조절반응이 저하(악화)될 때와 같이 T-cell의 반응이 내려가는 일관적인 패턴을 보였다”고 설명했다.
오 박사는 이 점으로 미뤄 마이크로바이오타의 부재가 면역반응을 더욱 활성화시킨다고 풀이했고 “더 나아가 특정한 마이크로바이옴에 의존한 iNKT cell 피노 타입의 메커니즘을 밝히고자 탐구하게 됐다”고 연구 배경을 설명했다.
오 박사에 따르면 iNKT cell은 일반적인 T cell과는 구별되어 CD1d라는 라이간드에 제한되고 당지질(glycolipid)에 반응하는 특징을 보인다. 그는 “박테리아의 존재가 iNKT cell을 조정할 수 있다면 대장의 마이크로바이타가 iNKT의 모듈레이터 라이겐드를 만들 수 있을지 고민하게 됐다”며 연구 설계를 주축을 설명했다.
오 박사는 “스핑고지질(sphingolipid)는 박테리아에서 흔하게 발견되는 지질은 아니지만 특이하게 박테리아 프레즐리스(B. fragilis)라는 장내 세균은 스핑고지질을 생산할 수 있다”고 지적하며 “이 점에 착안해 스핑고지질을 없애면 세균 내 환경이 어떻게 변화되는지 확인했다”고 말했다.
오 박사는 무균쥐에 스핑고지질이 제거된 B. fragilis를 이식해 단일 군체를 형성하게 되면 무균 쥐와 비슷한 형태로 iNKT cell이 높게 증가하는 반면에 정상적인 B. fragilis은 보통의 쥐의 수준만큼 iNKT cell을 낮게 유지하는 것을 확인할 수 있었다.
B. fragilis가 생산하는 지질의 종류 중 알파 갈락토실세라마이드( α-galactosylceramide, α-GCs)에 주목하게 됐는데 α-GCs가 CD1d 라이겐드로 작동하는 iNKT cell 활성인자이기 때문이다. 연구팀은 정제된 지질을 막 태어난 쥐에게 이식했을 때에 마찬가지로 이 무균쥐에는 스핑고지질이 제거된 박테리아가 군집을 이루기 때문에 무균쥐에게는 iNKT cell이 높고 질병에 민감도가 나타난 점을 확인했다.
BfaGCs는 NKT 작용제와 다를까?…박테리아가 만든 대사물질이 면역조절 반응 일으켜
|
오성환 박사는 "스핑고지질로 인해 나타나는 면역조절반응이 나타난다는 것은 B. fragilis α-GCs가 면역반응을 조절하는 라이겐드임을 확인할 수 있는 근거가 됐다"며 “단순한 면역자극과는 구별되는 면역조절 기전이라는 점에서 중요점이 있다”고 강조했다. 오 박사는 가설을 구체화 시키기 위해 이 대사물질의 ▲화학적인 특징 ▲구조활성상관관계 ▲생체 내 면역반응 ▲리간드 수용체 상호작용 및 구조를 규명해 NKT cell에 반응하는 라이겐드를 찾아낼 계획을 세웠다.
오성환 박사는 “B. fragilis가 어떤 종류의 α-GCs를 생산하는지 확인한 결과 다양한 사슬 길이와 더불어 여러 가지 브랜치 패턴으로 구조적 장애를 만드는 것으로 나타났다. 연구진은 20개가 넘는 화학 동종체(chemical homologues)를 고안해냈고 생물학적 상호작용이 실제로 일어나는지 관찰하자 절반 정도는 확실한 상호작용을 보였다”고 말했다.
화학 구조적인 상관관계를 확인했지만 실제로 생체 내에서도 동일한 생물학적 반응을 일으키는지 확인할 필요가 있었다. 오 박사 연구팀은 박테리아 라이겐드는 일반적인 NKT 작용제와는 다른 차이점이 있다고 판단했다. 항원표출세포와 비교해도 훨씬 적은 APC 활성화를 보이는 것으로 나타났다.
그럼에도 박테리아 라이겐드는 면역반응을 일으킬 수 있는 특정 유전자들을 발현시켰고, 결과적으로 면역 조절 반응을 일으키는 메커니즘을 가지고 기능을 하는 것을 확인했다. B. fragilis와 같은 장내 공생균이 만들어내는 면역조절 대사물질이 존재하고 이러한 대사물질이 CD1d와 같은 분자의 라이겐드로 작동함에 따라 NKT cell을 활성화시켰다는 것.
오성환 박사는 “B. fragilis는 BfaGCs와 더불어 생체 내 환경에서 초기 단계에 크게 증폭하는 특징을 가진다. 이에 따라 면역조절반응을 활용한다면 예방적인 차원에서 치료물질로 쓰일 가능성이 있다”고 전했다.
또한 “현재는 장내 세균 이식과 같은 전통적인 방식이나, 외부적인 프로바이오틱스의 주입, 특정 박테리아의 증식을 위한 환경 조성, 파지를 이용한 특정 바이오틱스 증식, 칵테일 요법과 같은 마이크로바이옴을 이용한 치료 환경이 조성되고 있다”고 설명했다. 그는 덧붙여 “현재 많은 연구실에서 마이크로바이옴를 활용해 감염병이나 IBDs(Inflammatory Bowel Disease) 항암면역치료제, 백신 보조제와 같은 치료제를 고안하기 위한 임상이 진행되고 있다”고 말했다.
[관련기사]
마크로젠 '마이크로바이옴'기반 '퍼스널 헬스케어' 확대 목표
2021-10-29 06:00
전체댓글 0개
등록된 댓글이 없습니다.
오늘의 헤드라인
-
01 미국·중국 지정학적 긴장 고조..글로벌 제약... -
02 카스큐어테라퓨틱스,유전자가위 기술로 '병... -
03 한미약품, 세계 첫 ‘근육 증가’ 비만신약 임... -
04 인트론바이오, 대장암 모델 독소제어 실증시... -
05 SK바이오팜, '세노바메이트' 미국 분기 매출... -
06 아미코젠,'키토올리고당' 소재 폐질환 개선... -
07 무신사 '소담상회', 누적 판매액 30억원 돌파 -
08 올리브영, KCON LA에 역대 최대 규모 K-뷰티... -
09 대웅제약, 대한종합건강관리학회와 디지털 ... -
10 큐라클, 당뇨병성 신증 치료제 'CU01' 국내 ...











