뉴스
코로나19-독감 동시진단 시약 1개 정식 허가
식약처, 정식 허가 신청 진단시약 30개 제품이 심사 중
박선혜 기자 │ loveloveslee@yakup.com


입력 2020-11-03 13:43 수정 2020.11.04 06:19

|
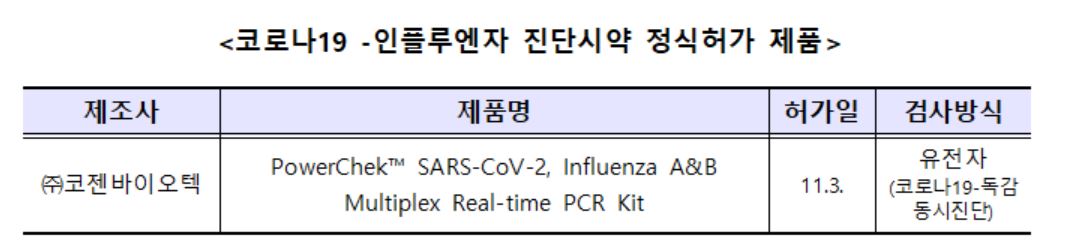
이번에 허가받은 동시진단 시약은 기침, 인후통 및 발열 등 증상이 비슷해 구분이 쉽지 않은 코로나19와 인플루엔자를 동시에 진단할 수 있는 제품이다.
이 제품으로 의심 환자의 검체를 검사하는 경우 한 번의 검사로 3~6시간 이내에 진단결과를 동시에 얻을 수 있어, 검사시간을 단축시키고 빠른 시간 내에 적절하게 처치할 수 있게 되는 등 환자의 편의성을 제고하고 의료인의 부담을 덜 수 있다는데 큰 의미가 있다.
|
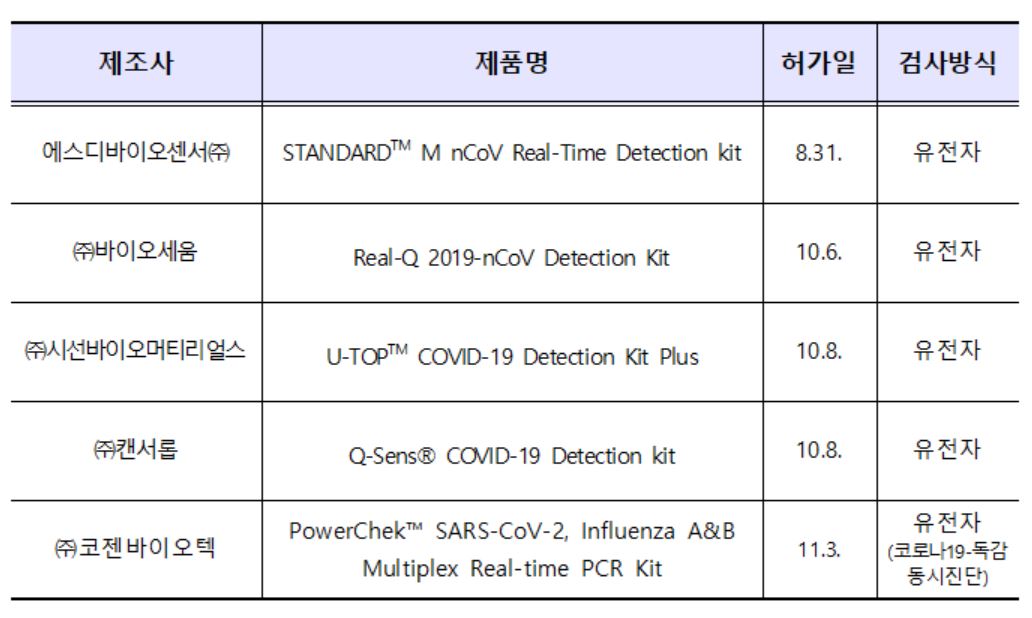
이로써 식약처는 코로나 19 유전자 진단시약 5개(5개 업체)를 허가했다.
|
현재 정식허가를 신청한 진단시약은 유전자 진단시약 14개, 항원 진단시약 5개, 항체 진단시약 11개로 총 30개 제품이 심사 중에 있다.
전체댓글 0개
등록된 댓글이 없습니다.
오늘의 헤드라인
-
01 알테오젠 파트너사 MSD, ‘키트루다SC’ 유럽 ... -
02 하엘, 푸단대와 손잡고 주름 개선 신물질 ‘E... -
03 명인제약, 청약 증거금 17조 3,634억원…경쟁... -
04 차바이오텍 CGT 전초기지 '마티카바이오', ... -
05 SK케미칼, 2200억원 규모 교환사채 발행 결... -
06 메디톡스, 콜산 성분 지방분해주사제 ‘뉴비... -
07 K-뷰티, 글로벌 확장 속 과제는 ‘변화 대응’ -
08 종근당, 국내 제약업계 최초 AI 기반 지능형... -
09 “CGT 혁신, 글로벌서 해법 찾다” 차바이오 '... -
10 티앤알바이오팹, ‘바이닥터엘리’와 미국 하...











