위축성 흉터 재생 효과 본격 입증...독자적 오가노이드 기술로 기존 치료 한계 극복

|
오가노이드 재생치료제 전문 기업 셀인셀즈(CellinCells, 대표 조재진)는 식품의약품안전처로부터 위축성 흉터 재생 치료제 후보물질 ‘TRTP-101’의 제2상 임상시험계획(IND)을 승인받았다고 27일 밝혔다.
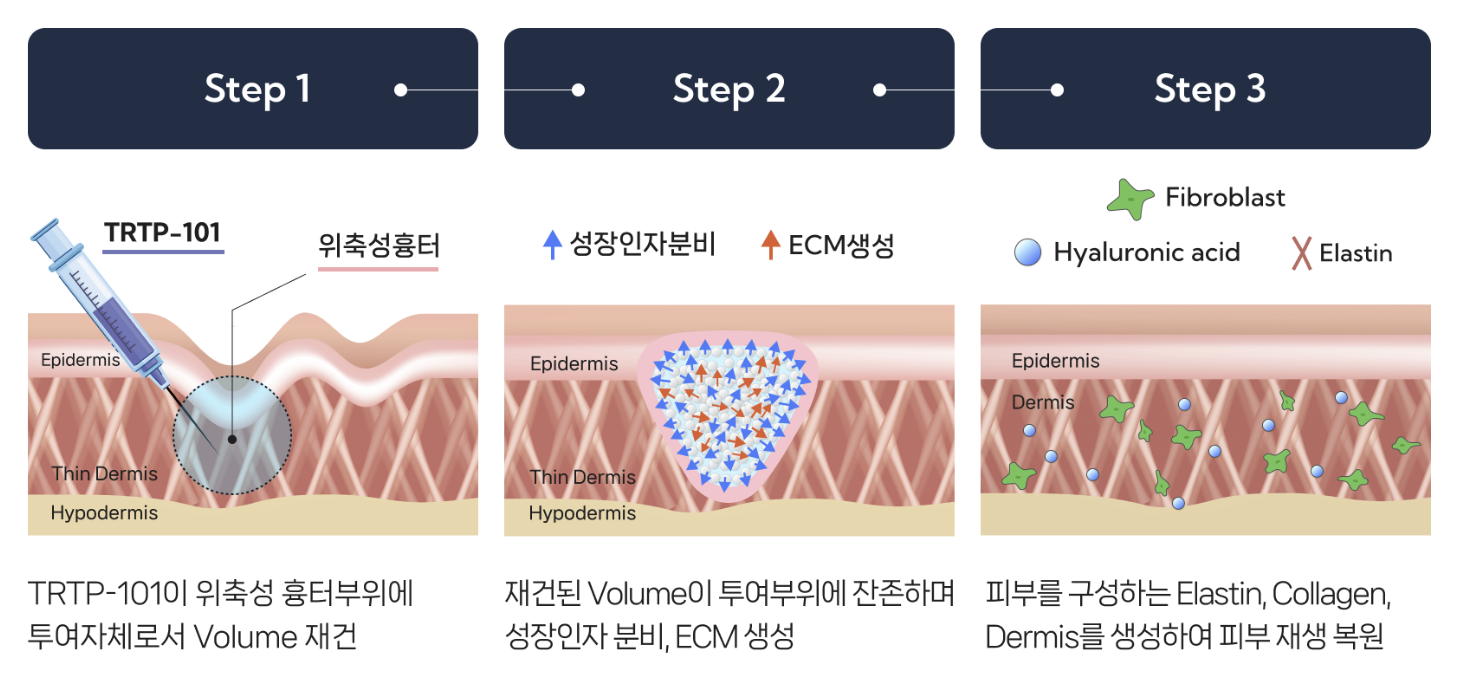
이번 임상 2상 승인은 앞서 진행된 임상 1상에서 확보한 안전성 및 재생 효과에 대한 긍정적인 결과를 바탕으로 이뤄졌다. 셀인셀즈는 임상 1상을 통해 TRTP-101의 우수한 내약성과 안전성을 확인했으며, 위축성 흉터 부위의 흉터 부피가 최대 26.6% 감소하는 등 유의미한 재생 효과(PoC, 개념 증명)를 입증한 바 있다.
임상 1상에서 확인된 피부 구조 재생 효과를 토대로, 임상 2상에서는 위축성 흉터 환자군을 대상으로 TRTP-101의 치료 유효성을 보다 정밀하게 검증할 계획이다. 셀인셀즈는 객관적인 임상 지표를 통해 실제 의료 현장에서의 치료 효과를 명확히 입증하고, 향후 허가를 위한 핵심 근거를 확보한다는 전략이다.
TRTP-101은2025년부터 범부처재생의료기술개발사업단이 주관하는 재생의료 치료제·치료기술개발 과제에 선정돼 국가적 차원의 지원을 받고 있다. 해당 사업은 2030년까지 총 5955억원이 투입되는 대규모 국가 연구개발 사업으로, 재생의료 분야의 연구부터 임상, 사업화까지 전주기 단계를 지원한다.
셀인셀즈가 수행 중인 과제는 재생의료 치료제의 허가용 임상 승인 및 수행을 집중적으로 지원하는 사업으로, 이를 통해 임상 2상 진행은 물론 오가노이드 치료제의 핵심 경쟁력인 CMC(제조공정 및 품질관리) 고도화와 대량 생산 공정 확립에도 속도를 내고 있다. 이는 연구 단계에 머무르지 않고 글로벌 시장 기준에 부합하는 재생의료 완제품을 상용화하겠다는 전략의 일환이다.
셀인셀즈의 TRTP-101 외에도 오가노이드 연골재생 치료제(TRTP-201)가 범부처 사업단의 지원 과제로 선정되어, 식품의약품안전처의 임상 IND 승인을 위한 연구개발을 진행하고 있다.
위축성 흉터는 진피층 콜라겐 소실로 인해 발생하며, 환자의 삶의 질과 심리적 만족도에 큰 영향을 미치지만 현재까지 근본적인 재생 치료제가 부재한 영역으로 평가받고 있다. TRTP-101은 피부 조직의 구조적 회복을 유도하는 차세대 오가노이드 기반 재생 치료제로, 기존 치료법의 한계를 극복할 혁신적 대안으로 기대를 모으고 있다.
셀인셀즈 조재진 대표는 “이번 임상 2상 IND 승인은 셀인셀즈의 오가노이드 재생 기술이 연구 단계를 넘어 본격적인 상용화 단계로 진입했음을 의미한다”며 “임상을 차질 없이 완수해 위축성 흉터 환자들에게 새로운 치료 옵션을 제공하고, 글로벌 재생의료 시장을 선도하는 기업으로 도약하겠다”고 밝혔다.
한편, 셀인셀즈는 임상 2상 결과를 기반으로 국내외 시장 진출을 가속화하는 동시에, 기존 세포 치료제의 한계를 극복하는 후속 오가노이드 기반 파이프라인 확장과 글로벌 제약·바이오 기업과의 전략적 파트너링도 지속적으로 추진할 계획이다.
-
01 삼성바이오에피스, 염증성 장질환 심포지엄 ... -
02 코아스템켐온, 식약처 ‘동물 대체 독성평가’... -
03 셀인셀즈, 위축성 흉터 신약 ‘TRTP-101’ 2상... -
04 김위학 회장 "기형적 약국·한약사 문제, 더 ... -
05 정부 약가 개편안에 뭉친 제약계와 노동계..... -
06 한국,지난해 미국 FDA 승인 바이오시밀러 ‘... -
07 신라젠, ‘SJ-650’ 연구 논문 최정상급 저널 ... -
08 큐라클,신장질환 치료제 'CU01' 신규 용도특... -
09 이엔셀, 샤르코-마리-투스병 치료제 ‘EN001’... -
10 입셀-아주대의료원, 알츠하이머 환자 유래 i...











