FDA,10년간 총 81개 승인..지난해 18개...‘휴미라’ 10개 최다

지난해 국내 제약바이오기업이 미국 FDA로부터 가장 많은 바이오시밀러를 허가받았다. 또 지난해 승인받은 바이오시밀러는 총 18개로, 휴미라 바이오시밀러가 가장 많았다.
미국 FDA가 26일 공개한 ‘2025년 허가 바이오시밀러 현황(Biosimilar Product Information)’에 따르면 2025년 한 해 FDA는 총 18개 바이오시밀러를 승인했다. 여기에는 이전 승인된 바이오시밀러가 없었던 3개의 참조 제품에 대한 4개 바이오시밀러가 포함된다.
허가받은 18개 바이오시밀러를 국적별로 구분하면 한국이 5개로 가장 많이 허가받았고 △인도 4개 △독일 및 중국 각 3개 △미국 2개 △영국 및 프랑스 각 1개 허가받았다. 한국은 2024년에 이어 2025년에도 바이오시밀러를 가장 많이 허가받은 나라가 됐다.
2025년 허가된 바이오시밀러 중 3개(인터체인저블 바이오시밀러=Merilog :참조 제품 Novolog , Omlyclo: 참조 제품 Xolair, Poherdy:참조 제품 Perjeta)는 상호 교환 가능한 바이오시밀러로 승인됐다. (주 법에 따라 처방 의사 개입 없이 약국에서 참조 제품 대체할 수 있음)
|
올해 허가 첫...Neupogen 바이오시밀러 ‘Filkri’
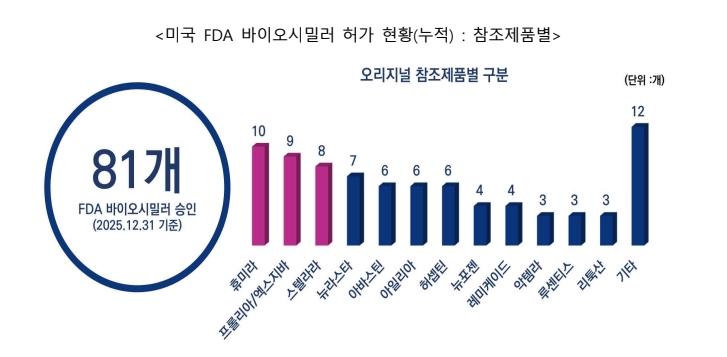
한편 FDA는 2015년부터 2025년까지 20개의 참조 제품에 대해 총 81개 바이오시밀러를 승인했다.
세부적으로 △Humira 바이오시밀러 10개 △Prolia/Xgeva 바이오시밀러 9개 △Stelara 바이오시밀러 8개 △Neulasta 바이오시밀러 7개,△Avastin, Eylea,Herceptin 바이오시밀러 각 6개, △Neupogen 및 Remicade 바이오시밀러 각 4개 △Actemra, Lucentis, Rituxan바이오시밀러 각 3개 △ Enbrel, Lantus, Novolog, Soliris에 바이오시밀러 각 2개 △Epogen/Procrit, Perjeta, Tysabri, Xolair 바이오시밀러 각 1개다.
연도별로, 2015년 최초로 바이오시밀러가 허가된 이래 2024년과 동일하게 2025년 가장 많은 바이오시밀러가 허가됐다. (△2015년 1개 △2016년 3개 △2017 년 5개 △2018년 7개 △2019년 10개 △2020년 3개 △2021년 4개 △2022년 7개 △2023년 5개 △ 2024년 18개 △ 2025년 18개)
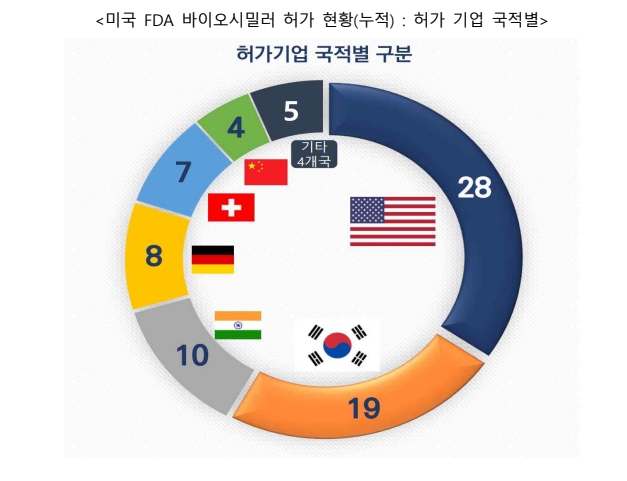
허가받은 기업을 국적별로 구분하면 △미국 28개 △한국 19개 △인도 10개 △독일 8개 △스위스 7개 △중국 4개 △아이슬란드 2개 △대만 1개 △프랑스 1개 △영국 1개다.
2026년도에는 1월 15일 미국 Accord BioPharma의 Neupogen 바이오시밀러 ‘Filkri’(filgrastim-laha)가 첫번 째 바이오시밀러로 허가받았다.
|
한편 FDA는 바이오시밀러 허가 경로는 FDA가 승인한 바이오의약품(‘참조 제품’)과 매우 유사하고 안전성, 순도 및 효능 측면에서 임상적으로 의미 있는 차이가 없는 생물학적 제품에 대한 축약된 승인 경로로, 이 경로는 더 많은 치료 옵션을 제공하고, 환자의 접근성을 높이고, 경쟁을 통해 치료 비용을 잠재적으로 줄이는 데 도움이 된다고 설명하고 있다.
-
01 한국,지난해 미국 FDA 승인 바이오시밀러 ‘... -
02 신라젠, ‘SJ-650’ 연구 논문 최정상급 저널 ... -
03 큐라클,신장질환 치료제 'CU01' 신규 용도특... -
04 이엔셀, 샤르코-마리-투스병 치료제 ‘EN001’... -
05 입셀-아주대의료원, 알츠하이머 환자 유래 i... -
06 트럼프 대통령, 한국산 의약품 25% 관세 위... -
07 브렉소젠 아토피 치료제 'BRE-AD01',미국 임... -
08 삼일제약, 아일리아 바이오시밀러 ‘아필리부... -
09 지씨셀,'이뮨셀엘씨주' 글로벌 기술이전 성... -
10 지노믹트리,100억원 규모 인프라 투자 결정....











