

|
퇴행성 뇌질환의 대명사인 파킨슨병 치료는 그간 도파민 신경세포의 사멸을 늦추거나 부족한 신경전달물질을 보충하는 수준에 머물렀다. 국내 연구진이 이 판도를 근본적으로 바꿀 가능성을 제시했다.
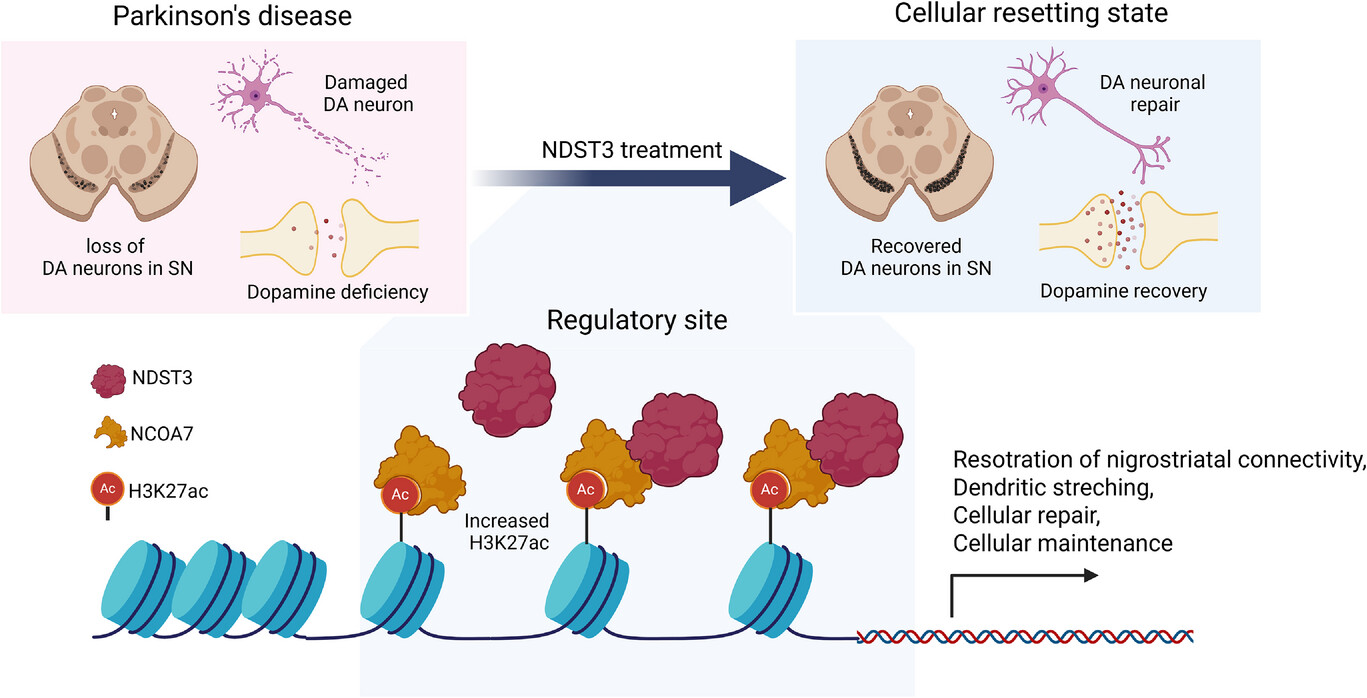
스탠드업테라퓨티스(StandUp Therapeutics) 창업자 유준상 박사 연구팀과 서울대학교 생명과학부 김종서 교수 연구팀은 손상된 파킨슨병 신경세포의 후성유전학(epigenetics) 균형을 되돌려 본래 기능을 회복시키는 ‘세포초기화(Cell Resetting)’ 메커니즘을 보고했다. 핵심은 ‘NDST3’라 불리는 유전자를 활용해 손상된 세포의 후성유전학적 불균형을 되돌리는 ‘세포초기화(Cell Resetting)’ 기술이다.
이번 성과는 Wiley 출판사의 국제 학술지 Advanced Science에 ‘NDST3-induced Epigenetic Reprogramming Reverses Neurodegeneration in Parkinson’s Disease(NDST3가 유도하는 후성유전학적 리셋이 파킨슨병 신경세포의 퇴행을 되돌린다)’라는 제목으로 게재됐다.
세포초기화는 줄기세포나 유도만능줄기세포(iPSC)를 이용하는 기존 방식과 다르다. 새로운 세포를 만들어 이식하는 대신, 이미 존재하는 신경세포의 후성유전학적(epigenetic) 상태를 되돌려 본래의 기능을 회복시키는 방식이다.
줄기세포 치료의 고질적인 문제였던 종양 형성 위험과 면역 거부 반응 가능성이 상대적으로 낮고, 환자 자신의 세포를 체내(in vivo)에서 직접 복원하기 때문에 세포 공급의 제약도 적다. 산학계에선 “직접 교차리프로그래밍(direct reprogramming)의 안전성과 효율성을 동시에 겨냥한 기술”이라고 평가하고 있다.
파킨슨병은 중뇌의 도파민 신경세포가 점차 소실되고, 세포 내에 α-시누클레인(α-synuclein) 단백질이 비정상적으로 축적되면서 발생한다. 유 박사팀은 이 과정의 중요한 분기점이 NDST3(N-deacetylase/N-sulfotransferase 3) 유전자의 기능 저하에 있음을 밝혀냈다.
NDST3는 세포 내에서 히스톤(histone)과 α-튜불린(α-tubulin)의 아세틸화 균형을 조절하는 역할을 한다. 히스톤 아세틸화는 유전자의 발현을 켜거나 끄는 후성유전학적 스위치로, 세포의 생존과 기능 유지에 필수적이다.
연구팀은 파킨슨병 환자와 파킨슨병 동물 모델 모두에서 NDST3의 발현이 크게 떨어져 있는 것을 발견했고, 중뇌신경세포 마커 유전자 의 히스톤 탈 아세틸화를 일으킨다는 사실을 규명했다. 이로 인해 도파민성 신경세포의 기능 저하가 야기되며 파킨슨병을 가속한다.
즉, NDST3는 신경세포의 ‘후성유전학적 조절자(epigenetic modulator)’로서, 이 유전자의 기능을 복구하면 세포는 본래의 건강한 상태를 기억해내며 다시 회복 경로로 진입한다.
|
연구팀은 NDST3가 히스톤 아세틸화를 일으키기 위해 NCOA7(Nuclear receptor coactivator 7)이 함께 작동해 신경세포 생존 경로를 조절한다는 사실도 밝혔다. 두 인자는 세포 내 H3K27ac 증가 등 히스톤 아세틸화 및 크로마틴 접근성 증가를 통해, BDNF, Nurr1, Vmat2 등 신경세포 생존 관련 유전자의 발현을 되살리는 조절 축으로 작용했다.
이 NDST3-NCOA7 조절 축은 파킨슨병뿐 아니라 알츠하이머병·루게릭병(ALS) 등 다른 신경퇴행성 질환에서도 공통으로 작용할 가능성이 제시됐다. 연구팀은 이 메커니즘이 향후 다양한 뇌질환의 후성유전학 기반 치료 전략으로 확장될 수 있을 것으로 내다봤다.
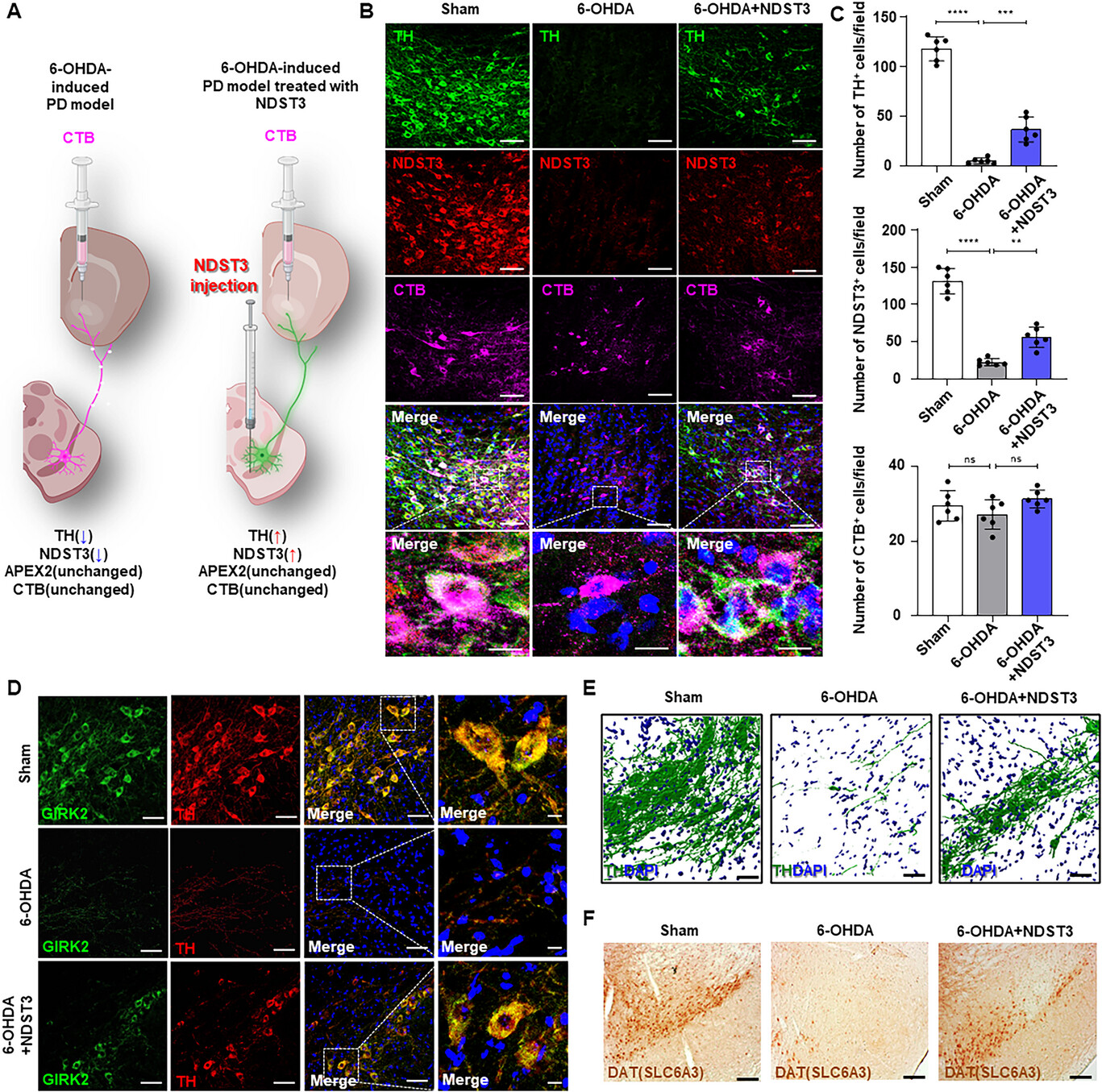
연구팀은 사람의 신경줄기세포에서 만든 3차원 뇌 오가노이드(3D brain organoid) 모델과 파킨슨병 생쥐 모델을 이용해 NDST3의 효과를 검증했다. NDST3를 활성화시킨 결과, 손상된 도파민 신경세포가 다시 살아났고, 도파민 합성 효소(TH), 시냅스 단백질(SYN1) 등 주요 신경세포 마커의 발현이 정상 수준으로 회복됐다. 또한 세포의 축삭과 수상돌기가 재형성됐으며, 실제 파킨슨병 모델 마우스의 운동장애가 개선됐다.
단일세포 전사체 및 공간전사 분석 결과에서 NDST3는 DNA 손상 회복, 시냅스 재형성, 미토콘드리아 기능 회복 등 수백 개의 유전자 경로를 재활성화시키는 것으로 확인됐다. NDST3는 세포의 후성유전학적 기억을 리셋(reset)시켜, ‘퇴행(degeneration)’에서 ‘재생(regeneration)’으로 전환시키는 스위치 역할을 한다는 것이 연구 결과로서 증명된 셈이다.
연구팀은 NDST3를 직접 표적으로 하는 AAV(아데노연관바이러스) 기반 유전자치료제 ‘STUP-002’를 개발 중이다. AAV 벡터를 이용해 NDST3 유전자를 중뇌에 전달, 신경세포 기능 회복을 유도하는 방식이다.
연구팀은 2026년 상반기 파킨슨병 환자를 대상으로 임상 1/2a상 개시를 목표로 준비 중이다. 초기 임상은 환자 대상으로 단계적 용량상승(sentinel dosing 또는 BOIN 설계)과 독립 DSMB(데이터안전위원회) 운영, 장기 추적 레지스트리 구축 등을 병행하는 방향을 검토 중이다.
평가 지표로는 DAT-SPECT, FDOPA-PET, 뉴로멜라닌 MRI 등 영상기법을 통해 도파민 경로의 회복 정도를 확인할 예정이다. 또 NfL, α-시누클레인 시딩 활성, NDST3-NCOA7 아세틸화 균형 등 분자 바이오마커를 활용해 표적 참여와 기전 작동 여부를 정량적으로 검증할 계획이다.
여기에 웨어러블 기반 디지털 엔드포인트(Digital endpoints)를 도입, 보행, 진전, 활동성 등의 객관지표를 연속적으로 측정하고, 장기 추적 데이터를 통해 치료 효과의 지속성과 안전성을 평가하는 방안도 함께 마련하고 있다.
연구팀은 이미 척수손상 환자를 대상으로 세포초기화 기술이 융합된 세포직접교차분화 기술 기반 ‘STUP-001’의 연구자주도 임상 1/2a상을 신촌 연대 세브란스병원에서 진행 중이다. 임상 운영 및 안전성 관리 경험을 파킨슨 임상 설계에도 접목할 계획이다.
유준상 박사는 “이번 연구는 재생의학이 오래 품어온 ‘손상된 신경을 인체 내에서 본래 상태로 되돌릴 수 있느냐는 질문에, 세포초기화(Cell Resetting)와 NDST3-NCOA7 축의 기전으로 구체적 해답을 제시했다는 데 의의가 있다”라고 밝혔다.
특히 유 박사는 “서울대 김종서 교수 연구팀의 단백체 기반 스크리닝이 핵심 인자 규명에 결정적이었고, 이러한 긴밀한 협업이 있었기에 임상 번역의 문턱까지 속도를 높였다”라고 전했다.
|
-
01 셀트리온 ‘옴리클로’,유럽 주요국서 첫 번째... -
02 씨엔알리서치,아이엠지티 ‘IMD10’으로 미국 ... -
03 티앤알바이오팹, PSI·ADM 등 주요 제품 글로... -
04 알테오젠바이오로직스,망막혈관 질병 치료제... -
05 삼성 라이프 사이언스 펀드, 중국 '프론트라... -
06 티움바이오 항암 신약 ‘토스포서팁’ WHO 국... -
07 [전문가 칼럼] 유럽 뷰티, 사후 스킨케어서 ... -
08 K-뷰티, 남미 진출 지금이 적기 -
09 AI, 신약 개발 전 과정 주도..."'자율화 연... -
10 보령, 3분기 매출 2800억…영업이익 51% 증가...











