
|
"제약바이오 디지털 전환은 단순한 자동화나 시스템 개선의 문제가 아닙니다. 글로벌 규제에 부합하는 '데이터 중심 품질 패러다임'으로의 전환이 핵심입니다."
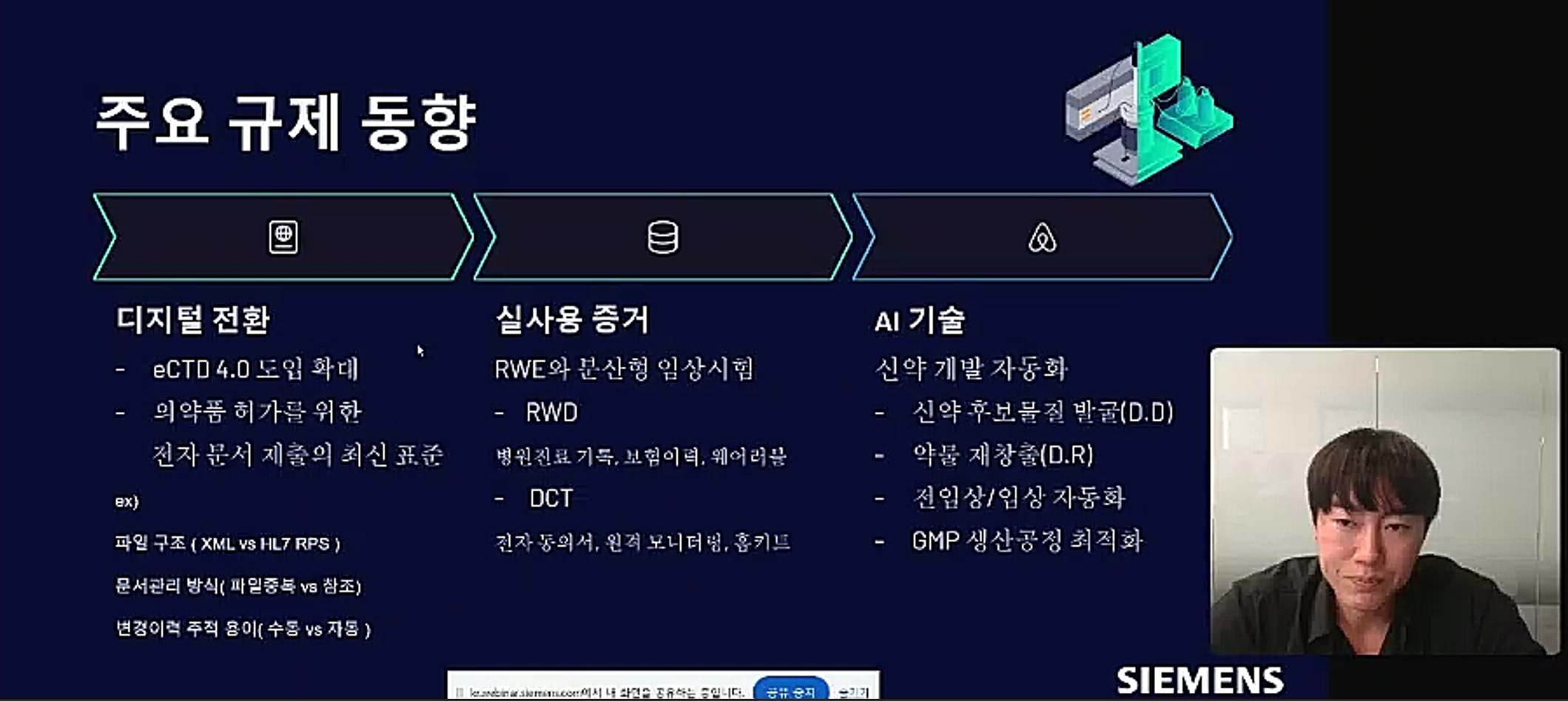
한국지멘스 디지털 인더스트리 마케팅부 김의태 차장은 최근 열린 '지멘스 제약 산업 이노베이션 웨비나'에서 이렇게 말했다. 그는 국제 전공통기술문서(eCTD 4.0)을 비롯한 글로벌 규제 환경의 변화, AI 기반 신약개발과 공정 최적화, ESG 대응까지 포괄하는 디지털 전환 로드맵을 제시했다
김 차장은 먼저 eCTD 4.0의 전면 도입 확대를 언급했다. 기존 문서 기반 허가 체계는 점점 사라지고, 전자문서 표준과 구조화된 데이터 전송(XML 기반 RPS 등)이 허가 조건으로 자리 잡고 있다는 분석이다. 문서 제출 방식만 해도 과거엔 PDF 파일명 일치 수준이었지만, 이제는 참조 중심 자동화 방식으로 진화하고 있다.
특히 변경 이력 역시 수기로 관리하던 시대는 지나가고, 실시간 추적이 가능한 자동 시스템이 요구되고 있다. 이러한 변화는 단순한 IT 시스템 도입 수준 문제가 아니라, 규제기관과의 디지털 커뮤니케이션 역량을 요구하는 구조로 재편되고 있다는 의미다.
김 차장은 "이 변화가 단순히 문서를 전산화하는 수준에 그치지 않는다"면서 "허가 전 과정에서 실시간 데이터 연동과 자동화된 이력 추적이 가능해야 하며, 기업 내부의 문서 관리 체계 또한 규제기관의 데이터 요구 수준에 맞춰 개편이 불가피하다는 압박이 커지고 있다"라고 말했다.
QbD로 품질관리 '패러다임 전환'…설계 단계부터 품질 내재화
기존 제약바이오 의약품 생산은 제조 완료 후 완제품을 검사해 불량 여부를 확인하고, 문제가 있으면 사후적으로 원인을 추적하고 조치하는 방식이 일반적이었다. 그러나 이 방식은 생산 리스크를 사전에 통제하기 어렵고, 품질 편차나 제품 회수 등으로 이어질 수 있는 구조적 한계를 가진다.
이에 따라 최근 글로벌 제약업계에서는 QbD(Quality by Design) 개념이 핵심 패러다임으로 부상하고 있다. QbD는 공정 설계 단계에서부터 품질을 설계 요소로 통합하는 접근이다. 품질의 주요 속성(CQA)을 정의하고, 이를 보장하기 위한 핵심 공정 변수(CPP)를 통계적으로 관리한다. 미리 정의된 허용범위(design space) 내에서 공정 변경을 유연하게 수행할 수 있도록 한다.
김 차장은 "전통적인 GMP 체계에서는 공정 조건을 일부만 변경해도 규제 당국의 재승인을 받아야 했다"라며 "QbD 기반 시스템에서는 '디자인 스페이스'라는 과학적 허용 영역 안에서의 변경은 자율적으로 진행할 수 있어 훨씬 민첩한 품질관리와 생산 운영이 가능하다"고 설명했다.
QbD는 특히 다국적 제약사나 글로벌 CDMO에게 전략적으로 중요하다. 동일한 제품을 여러 국가에 출시하거나, 생산 부지를 전환할 경우에도 일관된 품질을 유지하면서도 불필요한 승인 지연이나 규제 리스크를 줄일 수 있기 때문이다.
또한 QbD는 허가 신청 시에도 유리하게 작용한다. 품질 설계 근거와 사전 검증된 데이터가 축적돼 있으면, 규제기관은 해당 제품이 상업 생산 단계에서도 일관된 품질을 유지할 것이라는 신뢰를 할 수 있다. 결국 QbD는 '사후 대응'이 아니라 '사전 설계'에 기반을 둔 품질 보증 전략인 셈이다.
디지털 MES/EBR 시스템, '옵센터 이그제큐션 파마'
지멘스는 제약바이오 산업의 디지털 품질관리 체계를 구현할 핵심 솔루션으로 '옵센터 이그제큐션 파마(Opcenter Execution Pharma)'를 제시했다. 이 시스템은 제조실행시스템(MES) 및 전자 배치기록(EBR)을 기반으로 GMP 규제를 자동 반영하며, 품질 관련 주요 기능을 하나의 플랫폼에서 통합 운영할 수 있도록 설계됐다.
특히 표준작업지침서(SOP) 기반의 작업 지시, 실시간 공정 모니터링, 시정 및 예방조치(CAPA) 연계까지 지원한다. 수기 기록 중심의 기존 방식에서 벗어나 전자문서화, 감사 추적(Audit Trail), 배치 릴리즈 자동화를 구현할 수 있는 구조다.
김 차장은 "옵센터 이그제큐션 파마는 모든 규제 요건과 제품 품질에 대한 일관성을 하나의 시스템 내에서 보장할 수 있는 솔루션"이라며 "특히 기존에 수일에서 수십 일이 걸리던 제품 릴리즈 소요 시간을 획기적으로 단축할 수 있어, 글로벌 GMP 대응과 생산성 혁신을 동시에 실현할 수 있다"고 강조했다.
지멘스는 단일 기능 중심 시스템 도입을 넘어, 제약바이오 산업의 전주기를 아우르는 통합형 디지털 플랫폼 전략을 제안하고 있다.
김 차장은 "이제는 시스템을 하나씩 따로 도입하는 시대가 아니라, 데이터 흐름에 맞춘 통합 설계와 규제 대응 시나리오를 동시에 고려한 실행 전략이 필요한 시점"이라고 말했다. 이어 그는 "디지털 전환은 더 이 미래 과제가 아니다"라며 "허가 일정을 앞당기고, 품질을 표준화하며, 생산 리스크를 줄이는 생존 전략"이라고 강조했다.
|
-
01 KIMCo,상반기 부처협업형 스마트공장 구축 ... -
02 한미약품,상반기 매출 7522억 전년비 3.8%↓-... -
03 아이티켐, 공모가 상단 확정…25.5% 의무보유... -
04 종근당, ADC 기반 항암 신약 ‘CKD-703’ 미국... -
05 유한양행-신흥, 임플란트 공동사업 포괄적 ... -
06 지멘스DI "제약바이오, 허가·품질 기준 바뀌... -
07 수원시, ‘2025 뷰티썸 수원’ 참가기업 모집 -
08 온코크로스, 서울대병원과 차세대 인공지능 ... -
09 K-뷰티, 베트남서도 세계 최강 과시 -
10 휴앤바이옴, ‘블루미크 스킨베리어 모이스쳐...











