미국 24개-한국 12개-스위스 6개 ...인터체인저블 바이오시밀러 13개 허가
최다 허가 바이오시밀러 '휴미라' 10개...허셉틴 뉴라스타 각 6개, 아바스틴 5개

|
|
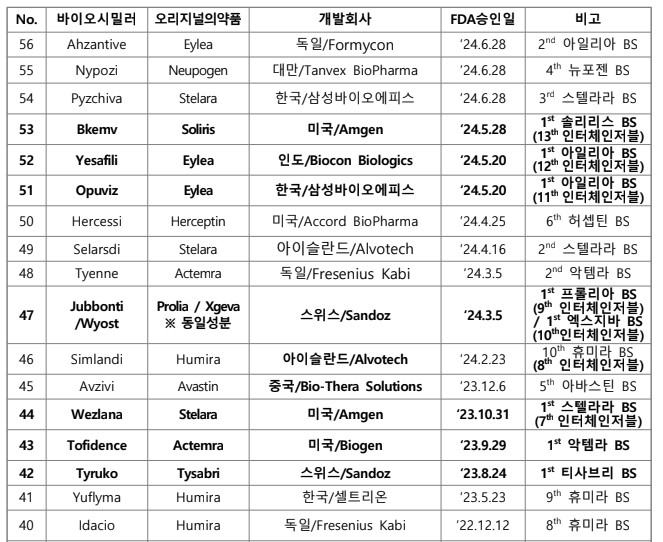
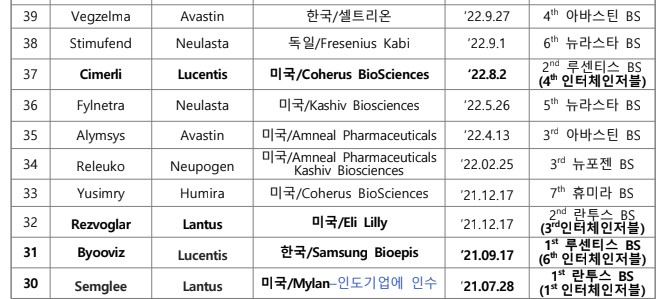
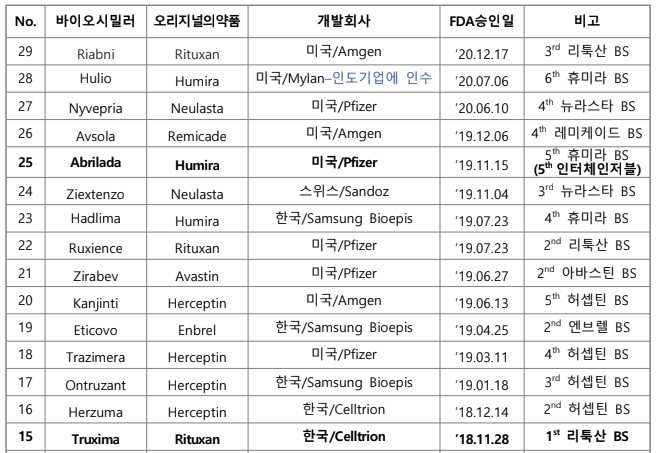
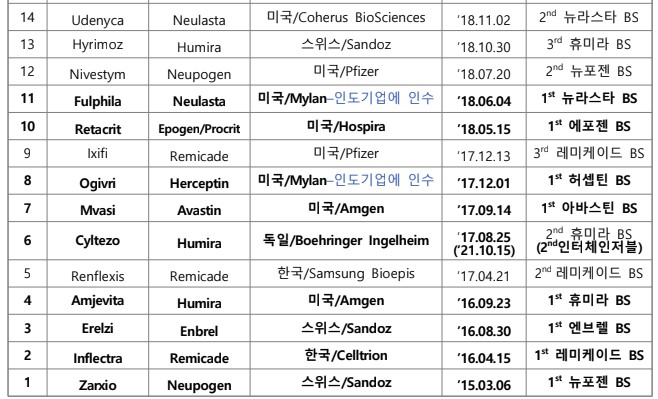
미국 FDA가 2024년 상반기까지 총 56개 바이오시밀러를 허가한 것으로 집계됐다.
한국바이오협회 바이어경제연구센터가 '미국 FDA Biosimilar Product Information'(7월 2일), '미국 FDA 바이오시밀러 허가 현황'(‘24.7.1기준)을 바탕으로 2일 낸 이슈 브리핑에 따르면 미국 FDA는 6월 28일 삼성바이오에피스의 스텔라라 바이오시밀러 'Pyzchiva', 대만 Tanvex BioPharma의 뉴포젠 바이오시밀러 'Nypozi', 독일 Formycon의 아일리아 바이오시밀러 ' Ahzantive' 등 3개 바이오시밀러를 허가했다.
스텔라라 바이오시밀러로는 3번째, 뉴포젠 바이오시밀러로는 4번째, 아일리아 바이오 시밀러로는 2번째 허가다. 이에 따라 2024년 6월말까지 총 56개 바이오시밀러가 FDA로부터 허가받았다.
바이오시밀러는 2023년 말까지 45개가 허가됐으며, 올해 상반기에만 11개가 허가됐다.
총 56개 바이오시밀러 중 인터체인저블 바이오시밀러로 13개가 허가 지정됐다.
그간 미국, 한국, 스위스, 독일 등이 주도했으나 최근 인도, 아이슬란드, 중국 등 새로운 국가 소재 기업들이 허가를 받았다.( 국가별 FDA 바이오시밀러 허가 개수 : 미국 24, 한국 12, 스위스 6, 독일 5, 인도 5, 아이슬란드 2, 중국 1, 대만 1)
이중 인도 기업은 미국 마일란(Mylan)을 인수함으로써 마일란이 허가받은 제품 4개와 자체적으로 1개를 허가받아 총 5개를 보유하게 됐다.
현재까지 가장 많이 허가된 바이오시밀러는 휴미라로 총 10개 바이오시밀러가 허가받았고, 허셉틴과 뉴라스타 바이오시밀러가 각각 6개, 아바스틴 바이오시밀러는
5개가 허가받았다.
반면, 솔리리스, 프롤리아/엑스지바, 티사브리, 에포젠에 대한 바이오시밀러는 각각 1개만 허가받았다.
|
|
-
01 큐리언트, 항암제 '아드릭세티닙' 임상1상 ... -
02 메디포스트, '카티스템' 임상 3상 IND 미국 ... -
03 인투셀,고형암 치료제 'ITC-6146RO' 임상1상... -
04 BMS 조현병 신약 중국서 동종 최초 치료제 승인 -
05 화장품 제조업 전망 다시 최고치… 관세 불확... -
06 스킨케어, 스트레스·수면까지 관리한다 -
07 고환율의 습격 vs 기회... 제약바이오 업계,... -
08 “10년, 강산 변했다” 대전 바이오 시총 53조... -
09 트럼프 약가 인하 압박…최혜국 가격제 확대... -
10 신한메디칼,호기산화질소 측정기 ‘Vyntus FE...











