뉴스
글로벌 '엑소좀' 신약 선두 '코디악' 임상 1상 막바지…"새로운 길 열다"
코디악 exoSTING 전·임상 1상서 긍정적 결과 확보로 엑소좀치료제 기대감 고조
권혁진 기자 │ hjkwon@yakup.com


입력 2022-06-13 06:00 수정 2022.06.15 19:06
글로벌 엑소좀치료제 개발 선두주자인 코디악 바이오사이언스가 KASBP에서 엑소좀 기반 치료제의 우수성을 발표했다. 특히 신약후보물질 'exoSTING'은 임상 1상이 마무리 단계로 엑소좀치료제의 성공 가능성에 대한 기대감을 높이고 있다.
지난 10일 재미한인제약인협회(Korean American Society in Biotech and Pharmaceuticals, KASBP)에서 ‘저분자 의약품 개발의 진전(Advancement in Small-Molecule Drug Development)’을 주제로 ‘2022 KASBP 봄 심포지엄’을 개최했다.
지난 10일 재미한인제약인협회(Korean American Society in Biotech and Pharmaceuticals, KASBP)에서 ‘저분자 의약품 개발의 진전(Advancement in Small-Molecule Drug Development)’을 주제로 ‘2022 KASBP 봄 심포지엄’을 개최했다.

|
▲좌측부터 인제니아 테라퓨틱스 추민경 이사, 코디악 바이오사시언스 장수철 박사
이날 심포지엄에 연자로 나선 코디악 바이오사이언스(Codiak BioSciences) 장수철 박사는 최근 각광받고 있는 엑소좀치료제의 가능성과 글로벌 선두에 있는 코디악의 엑소좀치료제 'exoSTING(CDK-002)'의 연구 현황을 소개했다.
엑소좀(Exosome)은 세포가 외부로 방출한 소낭성 입자로, 세포 간 신호전달에 주요한 역할을 하는 나노 크기의 물질이다. 세포유래 물질로 생체 안전성 및 적합성이 뛰어나 차세대 ▲약물전달체 ▲바이오마커 ▲치료제 등 다양한 활용이 전망되고 있다.
현재 엑소좀 기술은 초기 단계로 대부분 치료제는 전임상 단계며, 코디악 바이오사이언스가 선두에서 임상시험 1상을 진행하고 있다.
엑소좀은 지난 2007년 네이처 셀 바이오로지에 엑소좀을 매개로 mRNA와 microRNA의 세포 간 새로운 유전적 교환 메커니즘이 발표되며 전 세계적으로 주목을 받았다. 이후 2011년과 2017년 엑소좀을 통한 약물전달 기능이 실제 증명되면서, 치료제로서 가능성이 입증됐다.
장 박사는 “엑소좀은 기존 개발된 저분자 물질, 항체에 비해 복합적인 물질로 평가되고 있다”라며 “현재까지 밝혀진 물질만 수천여 개로, CD9, CD63, CD81 등의 다양한 단백질과 유전물질인 mRNAs, miRNAs와 DNA까지 포함된 것으로 알려져 있다”고 설명했다.
이어 “특히 세포유래 물질로서 세포치료제의 높은 생체 적합성, 면역원성, 생분해 등의 장점을 가지고 있고, 아울러 작은 크기로 세포 흡수 및 세포 내 전달이 가능해, 단백질, 저분자 물질, 핵산 등 여러 물질을 전달할 수 있는 나노파티클(Nanoparticle) 치료제의 장점도 가지고 있다”고 덧붙였다.
코디악은 정밀한 엑소좀 변형(Engineering)이 가능한 플랫폼 'engEX'을 개발해 엑소좀을 기능화하고, 다양한 모달리티(Modality)를 로팅(Loding)하는 기술을 연구 중이다. 또한 상용화를 위한 대용량 GMP 제조 기술도 확보해 개발하고 있다.
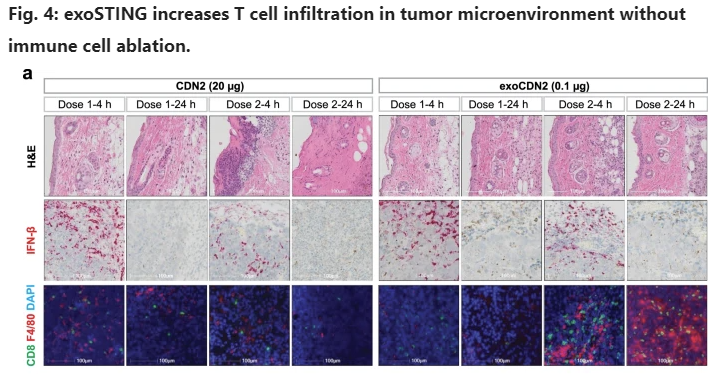
장 박사에 따르면 코디악의 'exoSTING(CDK-002)'은 정확한 표적화를 통해 치료 효과를 내는 맞춤형 엑소좀치료제다. 면역세포 활성을 유도하는 STING agonist(STimulator of INterferon Genes 작용제)의 기능을 갖는 동시에 약물 전달 및 독성 등의 한계를 극복하도록 개발했다. 엑소좀에 STING agonist를 로딩해, 원하는 항원제시세포(APCs)에 선택적으로 전달할 수 있도록 하고, 이를 통해 항종양 면역반응을 유도하고 전신 독성을 감소시켰다.
|
▲2021년 4월 22일 네이처에 게재된 exoSTING 연구 결과 중 일부 발췌(출처: ExoSTING, an extracellular vesicle loaded with STING agonists, promotes tumor immune surveillance, Nature)
in vitro(생체외) 실험 결과를 보면, 다양한 면역세포에 exoSTING를 처리했을 때, exSTING은 선택 특이적으로 단핵구(Monocyte)만 활성화 시키는 것으로 나타났다. 이에 반해 FSA(Free STING agonist)는 선택 특이성 없이, B세포를 제외한 T세포, NK세포, 단핵구 모두 활성화 시키는 것이 확인됐다. 또한 종양미세환경(Tumor Microenvironment)에 존재하는 M2 분극화 대식세포(Polarized Macrophage)의 경우, exoSTING이 효능을 더 강화시키는 것이 관찰됐고, 이는 적은 양으로도 선택적으로 항원제시세포(APCs)를 활성화시킨다는 것을 의미한다. 이와 더불어 exoSTING은 같은 효능을 보이는 농도에서 FSA 대비 독성(T cell Cytotoxicty)이 낮은 것으로 나타났다.
이어 in vivo(생체내) 실험 결과를 살펴보면, 두 가지 암(피하 주사, 폐 병변 유도)을 가진 모델에서 exoSTING은 개선된 항암 효능을 보였다. 특히 한 종양에만 exoSTING을 투여했을 때도 면역항암제 특성에 따라 전신에서 항 종양 효능이 확인됐다.
또한 면역기억반응(Immune memory response)을 확인하기 위한 폐 전이 활성을 관찰했을 때, exoSTING만 항종양 효능이 관찰됐다. 이를 통해 exoSTING은 원발성 종양을 표적 함과 동시에 면역기억반응 통해 전신에서 항종양 효능을 나타낸다는 것이 증명됐다. 실제 exoSTING은 종양미세환경으로 CD8+ T세포와 대식세포를 유도했다.
현재 exoSTING은 임상 1상이 진행 중이며, 코호트5 중 코호트4에 진입했다. 특히 임상시험 환자의 말초 혈액에서 용량 의존적으로 ISGs(interferon Stimulated genes), 항원제시세포 활성 및 성숙 유전자 등 인터페론 I형 신호가 유도되는 것으로 나타났다.
대표적인 임상 케이스를 살펴보면, 4가지 화학항암요법에서 치료 효과가 나타나지 않은 진행성 이하선(Parotid gland) 암 환자에게서, exoSTING이 투여된 부위의 종양에서 CD8 T세포 침윤이 3배 증가했고, 암세포 함량은 43~56% 감소한 것으로 나타났다. 특히 약물 주사한 부위가 아닌 다른 병변에서도 종양이 74% 감소한 것으로 관찰돼, 전임상에서 확인된 전신 효과(Distal effect)가 입증됐다.
장 박사는 “exoSTING은 전임상시험에서 개선된 종양 유지 효능과 우수한 약력학 효과를 나타내며 임상에서 치료 범위를 확장할 가능성을 제시했다”라며 “이를 바탕으로 임상 1상에서는 STING agonist의 종양 유지 효과가 나타났고, 안전성 및 내약성도 확인됐다. 특히 약물이 투여된 부위와 원위부에서 항종양 효능이 활성화되는 것은 주목할만하다”고 강조했다.
전체댓글 0개
등록된 댓글이 없습니다.
오늘의 헤드라인
-
01 휴온스, 2025년 매출 6208억원·영업익 456억... -
02 코넥스트, 희귀질환 신약후보 ‘CNT201’ 2상 ... -
03 바이오솔루션 "7년만 연결 기준 당기순이익 ... -
04 셀트리온그룹,대규모 임원 승진 인사...이... -
05 [주목 이 제품] 20년 넘게 선택받은 위염 치... -
06 강스템바이오텍, CDMO 위탁사 임상 1/2a상 I... -
07 JW중외제약, 탈모치료제 후보물질 ‘JW0061’ ... -
08 케어젠,근육성장 기전 규명 ‘마이오키’ SCI... -
09 광동제약 판권 보유 노안 치료제 ‘유베지’, ... -
10 팜젠사이언스–폴라리스AI파마, 신약·개량신...











