뉴스
한미약품의 신약개발…고비 넘기고 '재도약 실현'
신약파이프라인 항암제·염증 및 섬유증·대사성 질환·희귀 질환에 집중…ODD 17개 큰 성과
권혁진 기자 │ hjkwon@yakup.com


입력 2021-10-05 06:00 수정 2021.10.05 06:17
국내 신약개발 기업의 대표주자인 한미약품이 우수한 신약개발 성과와 기술수출 사례를 바탕으로 재도약 발판을 마련했다는 평가를 받고 있어, 향후 귀추가 주목된다.
|
㈜우정바이오(대표이사 천병년)는 국내 최초 민간주도 바이오클러스터인 우정바이오 신약클러스터(이하 우신클)의 출범을 기념해 ‘제1회 우신클 출범 기념 심포지엄’을 개최했다.
이날 심포지엄에서 한미약품 권세창 대표는 `신약개발과 기술수출 현황 및 성공 사례`를 주제로 국내 기술수출 현황과 한미약품의 미래 전략을 공유하는 시간을 가졌다.
권세창 대표는 글로벌 라이센스 트렌드가 변화하는 추세를 나타내고 있고, 코로나19 팬데믹으로 한국에게는 오히려 기회가 될 수 있다고 설명했다. 그는 “코로나19 팬데믹 영향으로 대부분의 글로벌 R&D센터들은 연구개발이 중단되거나 연기되는 일이 많았으나, 한국은 우수한 방역 조치로 인해 연구개발이 지속해서 진행될 수 있었다”라며 “팬데믹으로 인해 오히려 신약개발연구에서 1년 이상을 벌 수 있는 계기가 됐고, 이를 통해 앞으로 1년 내지 2년은 국내 기업에 유리하게 작용할 것으로 예상된다”고 전했다.
이어 “기술 이전에 있어서 이전에는 품목허가 단계에 있는 신약후보물질들을 큰 비용을 지불하더라도 거래하려는 경향이 있었지만, 현재는 허가단계에 있는 유망한 후보물질이 대부분 거래가 완료된 것으로 나타나, 일찍이 앞 단계에서 기술 거래를 하려는 경향이 나타나고 있다”고 설명했다.
특히 “mRNA 기술이 오랫동안 연구·개발돼 왔지만 큰 성과를 나타내지 못했으나, 코로나19로 인해 크게 도약했듯이, 앞으로는 유전자치료제, 세포치료제도 이번 계기를 빌미로 연구개발 및 라이센스 아웃이 가속화될 것으로 예상된다”라며 “또한 새로운 테크놀로지를 가지고 신약개발 및 기술 이전에 도전하는 것도 앞으로 좋은 기회가 될 수 있을 것”이라고 부연했다.
|
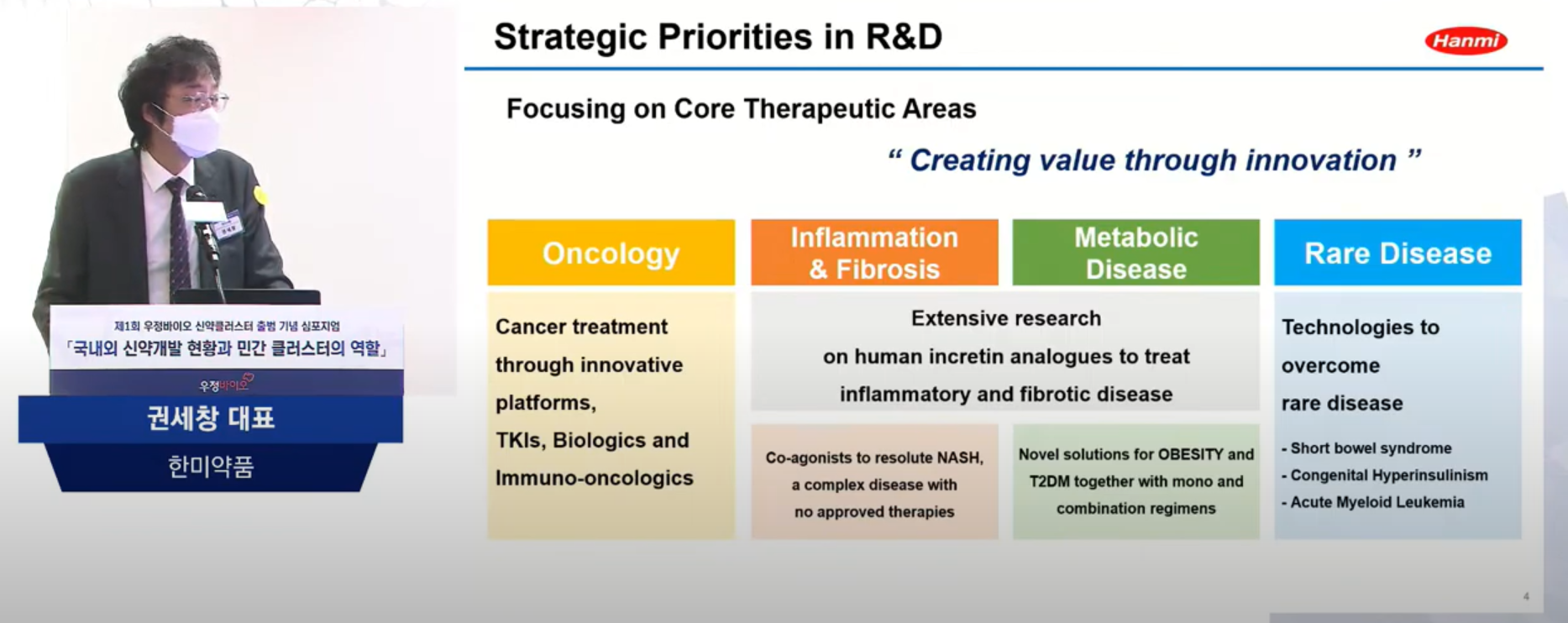
권세창 대표는 한미약품의 신약 파이프라인으로 크게 Oncology(항암), Inflammation & Fibrosis(염증, 섬유증), Metabolic Disease(대사성 질환), Rare Disease(희귀 질환)로 소개했다.
이 중 표적항암제는 꾸준히 연구개발해 오고 있는 분야며, 표적항암제 파이프라인 중 2~3개 이상은 이미 기술 거래가 완료됐다고 전했다. 현재 로슈의 계열사 젠넨텍에 라이센스 아웃한 `벨바라페닙(Belvarafenib)`은 올해 글로벌 임상으로 확대됐고, 현재 큰 특이사항 없이 진행 중이라고 덧붙였다.
또한 한미약품은 희귀질환치료제 개발을 활발히 진행하고 있으며, 희귀질환치료제의 글로벌 시장은 향후 22~25% 정도를 차지할 것으로 예측돼 성장 가능성이 높으나, 환자 수가 적은 만큼 환자 수를 모집하는 데 어려움이 있어, 임상개발 속도 전략을 잘 설정해야 임상시험 지연을 막을 수 있다고 설명했다.
한편 권 대표는 미국 Spectrum 사에 라이센스 아웃한 'Poziotinib(포지오티닙)'이 올해 안에 NDA를 신청할 예정이라고 밝혔다.
Poziotinib은 저분자 TKI(Tyrosine Kinsase Inhibitor) 비세포성 폐암 및 유방암 치료제로 개발 중에 있으며, EGFR/HER2 동시 억제 저분자 케미칼 화합물로 암세포가 성장할 때 비정상적 Kinase domain을 가진 EGFR/HER2가 발현 및 세포 표면에 과발현돼 암세포의 신장을 위한 신호전달이 이뤄지는데, 이때 Kinase domain에 Poziotinib이 결합해 신호전달 및 활성화를 억제해 암세포 증식을 차단하는 기전을 가졌다고 알려져 있다.
또한 제넨텍에 라이센스 아웃한 Belvarafenib은 2016년도에 임상을 진행하면서 제넨텍에 라이센스 아웃을 했고, 올해 로슈와 제넨텍에서 유효성이 높은 적응증 확인을 완료해 각 사에서 별도의 적응증을 목표로 임상시험에 진입할 계획이라고 권 대표는 설명했다.
Belvarafenib은 pan-RAF 저해제로 RAF/RAS 변이로 인해 활성화된 MAPK의 신호전달을 억제해 고형암의 성장을 저해한다고 알려져 있다.
지난 5월 서울아산병원 종양내과 김태원 교수팀은 종양 발현 유전자인 RAS와 RAF 변이가 발생한 암 환자 135명에게 Belvarafenib을 투여한 1상 임상시험 결과, 악성 흑색종과 대장암 환자에서 치료 효과를 확인했다고 밝힌 바 있으며, 이 연구 결과는 세계적인 과학 저널인 ‘네이처(Nature)’에 게재됐다.
지난 5월 서울아산병원 종양내과 김태원 교수팀은 종양 발현 유전자인 RAS와 RAF 변이가 발생한 암 환자 135명에게 Belvarafenib을 투여한 1상 임상시험 결과, 악성 흑색종과 대장암 환자에서 치료 효과를 확인했다고 밝힌 바 있으며, 이 연구 결과는 세계적인 과학 저널인 ‘네이처(Nature)’에 게재됐다.
또한 최근 유럽종양학회(ESMO)에서 Belvarafenib과 '코비메티닙(Cobimetinib)’을 함께 저용량 투여를 진행한 국내 임상1b상에서 병용투여 요법의 효능과 안전성을 확인한 결과가 긍정적으로 도출됐다고 밝힌 바 있다.
|
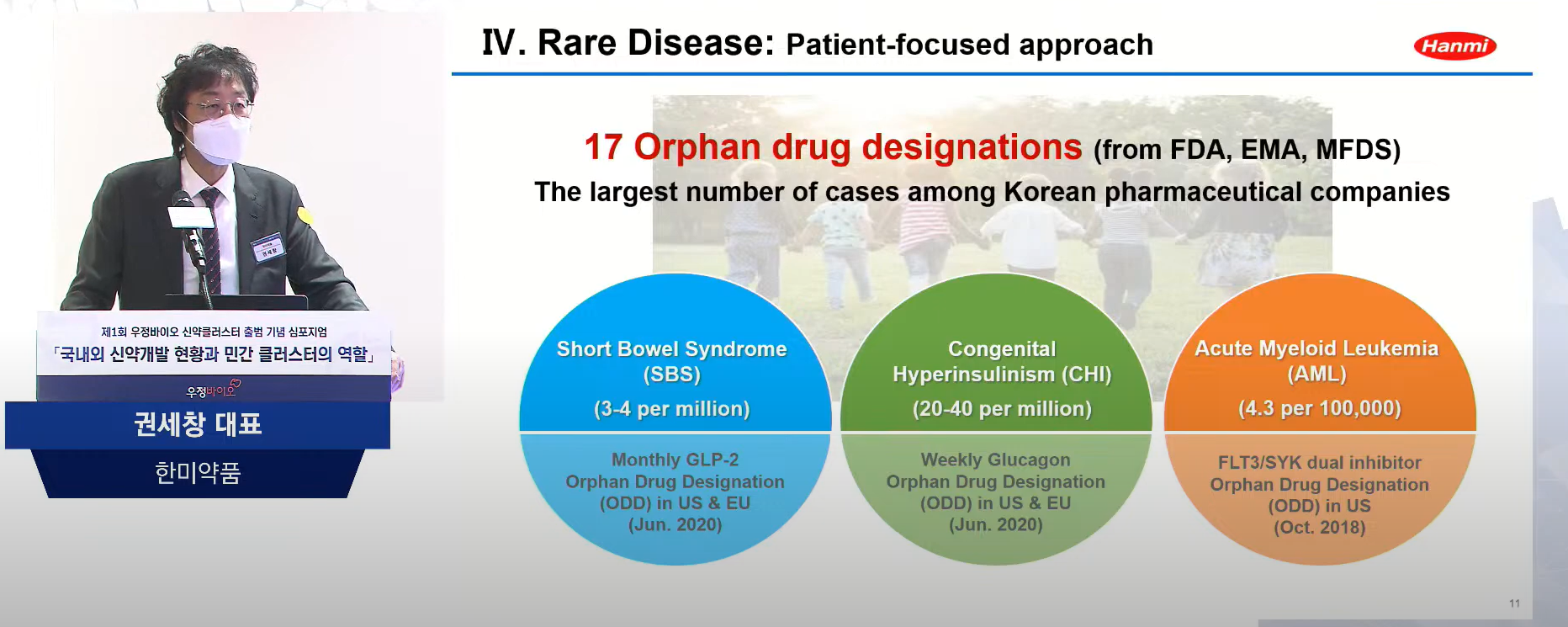
권 대표는 최근 한미약품에 주목할 만한 점으로 희귀의약품 개발에 성과를 나타내고 있다고 말했다. 그는 “국내 제약사 중 최다인 17개의 ODD(Orphan Drug Designations, 정부가 특정 약품을 희소 질환 및 난치 질환 치료제로 지정해 신속하게 허가하고 도입하도록 함)를 받았으며, 단장증후군(Short Bowel Syndrome), 선천적 과인슐린증(Congenital Hyperinsulinism), 급성골수성백혈병(Acute Myeloid Leukemia)에서 임상 2상을 2개 이상 진행 중”이라며 한미약품의 희귀의약품 개발에 밝은 전망을 제시했다.
이어 “국내 신약개발 기업들이 아직 부족한 점이 있지만, 제품에 있어서 글로벌 빅파마와 경쟁할 때 우리가 잘하는 포인트가 있으므로 이를 중점으로 꼭 필요한 데이터를 만들어 신약개발 및 라이센스 아웃의 기회 요소를 찾는 것이 중요하다”고 밝혔다.
희귀질환 임상시험 모집 어려움에 관한 질문에는 “희귀 질환을 전문으로 하는 병원에서 집중적으로 임상 디자인 설계를 진행하고, 미국의 FDA가 희귀질환 개발에 굉장히 적극적으로 지원을 하고 있기 때문에 이러한 지원책을 활용하면 어려움을 해소하는 데 도움이 될 수 있다”고 답변했다.
[관련기사]
한미약품, 단장증후군 혁신신약 개발 가능성 확인
2021-09-13 11:10
전체댓글 0개
등록된 댓글이 없습니다.
오늘의 헤드라인
-
01 삼성바이오로직스, 제60회 납세자의 날 '고... -
02 티카로스, 208억원 시리즈D 유치 성공…"CAR-... -
03 EU,생활화학제품 동물실험 금지…글로벌 안전... -
04 큐라클,CU01 신규 용도특허 미국 출원..국내... -
05 약업신문·한국당뇨협회, '당뇨협력약국' 전... -
06 우리그린사이언스,'아야나 바이오' 500만불 ... -
07 케어젠, 펩타이드 히알루노니다아제 'CG-Hy... -
08 대한혈액학회, '국제학술대회 ICKSH 2026' 3... -
09 에이비엘바이오-네옥바이오, 이중항체 ADC '... -
10 법무법인 율사서재,제약바이오·의료기관 특...











