뉴스
안바이오,“국내 제약사도 FDA 혁신의약품지정 노려봐야”
FDA 심사 부서와 긴밀한 협의가 관건… 임상 및 리뷰 단축해 신속한 런칭 가능
김상은 기자 │ kims@yakup.com


입력 2021-09-06 06:00 수정 2021.09.06 09:59
국내 시장을 벗어나 국제 무대에서 신약 출시를 계획하고 있는 바이오제약사들을 위해 FDA 전 부국장의 실질적인 조언을 공유할 수 있는 장이 마련돼 주목받았다.

|
안해영 대표는 무엇보다도 “신약 개발은 수천 개의 후보물질 중 의약품으로 완성되기까지 10년 이상의 장시간의 노력과 천문학적인 비용을 소요하는 하이 리스크(high risk) 비즈니스이기 때문에 성공 확률을 높이기 위해 신약 심사에 전략적인 계획이 필요하다”고 전했다.
안 대표는 “FDA 승인까지 도달하기 위해서는 심사 부서와 긴밀한 커뮤니케이션을 통해 심사에 소요되는 시간을 단축시키는 전략이 필요하다”고 말한다. 이를 혁신의약품지정(BTD) 체계를 적극적으로 활용하는 것을 고려할 수 있는데, BTD 절차를 밟게 되면 패스트트랙 절차의 장점을 모두 취하면서도 임상 1상부터 FDA 심사부서와 상의할 수 있는 기회가 늘어나기 때문이다.
원래 패스트 트랙(Fast Track)은 기존 치료제가 없는 심각한 질환에 대해 의학적 미충족 수요를 해결할 수 있는 가능성이 있는 의약품을 심사하는 과정이다. 비임상적 자료로도 신청이 가능하기 때문에 임상시험계획(IND)또는 Pre-IND 단계에서 서류를 제출한다. 또 순차제출(rolling submission) 절차를 통해 단계적으로 서류를 내기 때문에 시간적 여유를 확보할 수도 있다.

|
다만 안해영 대표는 “BTD를 신청하려면 임상적 데이터가 확인돼야 하기 때문에 패스트 트랙과 달리 임상 1/2상의 자료가 필요하다”며 “기존치료제 대비 효과가 우월한 경우 위약대비 이중맹검 임상에서 효과를 보인 경우 기존치료제와 병용 시 치료효과가 월등히 나아질 경우, 기존치료제 대비 부작용이 유의미하게 감소한 경우로 나누어 임상에 상당한 개선효과(substantial improvement)를 보여야 한다”고 설명했다.
이러한 이유로 BTD를 신청할 때는 유효한 IND단계에 있어야 하며 하나의 적응증에 적용할 수 있다. 이에 따라 BTD 신청 시, 임상보류(clinical hold)나 pre-IND 단계에서는 불가능하다는 것이 안대표의 설명이다. 안 대표는 “만약 국내 제약사의 경우 BTD 경험이 없다면 예비 혁신의약품지정(preliminary BTD) 절차를 활용해 BTD에 관한 자세한 과정을 안내 받을 수 있다”고 전했다.
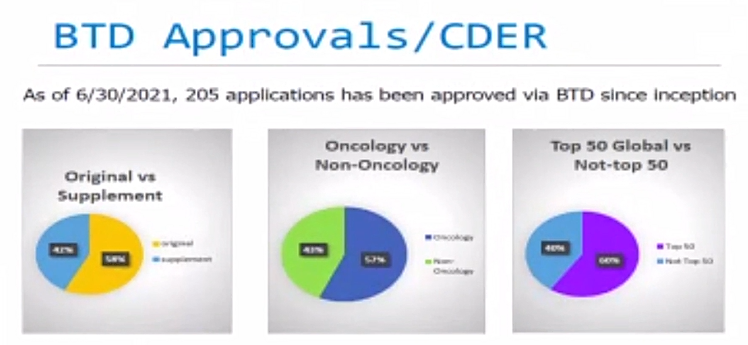
|
안 대표는 BTD를 통해 FDA에서 신약 승인을 받은 대표적인 사례들을 소개하며 “머크사의 조루증 치료제 로나파닙(lonafarnib)은 조루증이 심각한 질환이란 점, 2개의 임상 근거, 로나파닙 이전에 기존의 조루증 치료제가 없다는 점의 이유로 BTD에 포함됐다”고 설명했다.
비소세포폐암 치료제인 암젠의 소토라닙(sotoranib)은 기존의 비소세포폐암 치료제가 제시하지 못한 K-RAS를 타깃으로 한 혁신신약이란 점과 기존치료제 대비 높은 반응률(ORR)과 반응지속기간(DoR)을 보인 임상결과로 BTD에 신청할 수 있었다고 덧붙였다. 이외 노바티스의 항p셀릭틴 항체인 크리잔리주맙(Crizanlizumab)은 기존 치료제에 비해 심한 부작용을 획기적으로 줄여 위약대비 이중맹검 임상 2상에서 45%의 치료효과를 올린 것을 증명해 BTD 절차를 밟았다.
안해영 대표는 “BTD 절차를 활용한다면 FDA 신약 심사를 담당하는 CDER(합성신약 또는 바이오제제, 치료제 담당) 또는 CBER(백신 담당) 부서와의 긴밀한 협업을 나눌 수 있어 임상에 소요되는 시간·경비, 리뷰 기간의 절감, 최종 승인까지 기간을 줄여 빠른 런칭이 가능하다”고 말했다.
[관련기사]
신약 파이프라인 6500개 돌파..항암제 1위는 비소세포폐암
2021-06-17 11:05
전체댓글 0개
등록된 댓글이 없습니다.
오늘의 헤드라인
-
01 삼성바이오로직스, 제60회 납세자의 날 '고... -
02 티카로스, 208억원 시리즈D 유치 성공…"CAR-... -
03 EU,생활화학제품 동물실험 금지…글로벌 안전... -
04 큐라클,CU01 신규 용도특허 미국 출원..국내... -
05 약업신문·한국당뇨협회, '당뇨협력약국' 전... -
06 우리그린사이언스,'아야나 바이오' 500만불 ... -
07 케어젠, 펩타이드 히알루노니다아제 'CG-Hy... -
08 대한혈액학회, '국제학술대회 ICKSH 2026' 3... -
09 에이비엘바이오-네옥바이오, 이중항체 ADC '... -
10 법무법인 율사서재,제약바이오·의료기관 특...











