뉴스
아이진, mRNA 코로나19 예방백신 ‘EG-COVID’ 1/2a 임상 승인
건강한 성인을 대상으로 SARS-CoV-2에 대한 mRNA 백신(EG-COVID)의 안전성 및 면역원성 평가 목적
권혁진 기자 │ hjkwon@yakup.com


입력 2021-09-01 12:00
|
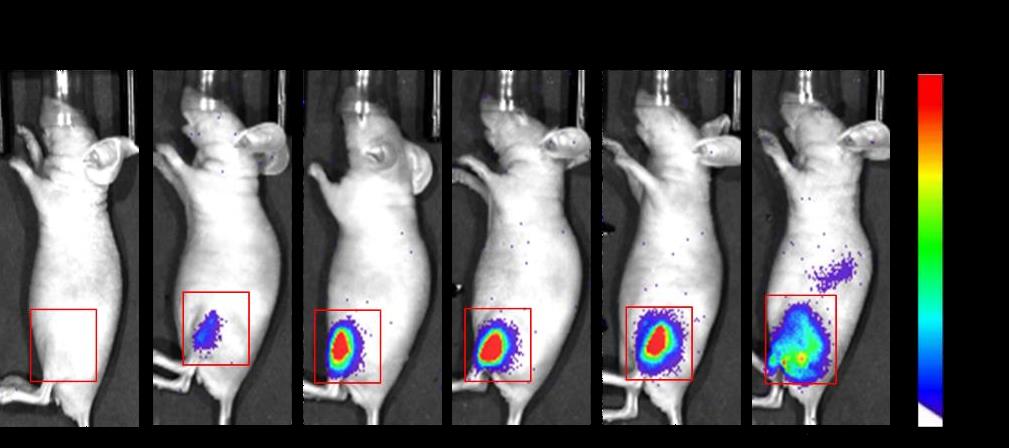
아이진 주식회사는 자체 개발 중인 mRNA 기반의 코로나-19 예방 백신 `EG-COVID`의 국내 임상 1/2a 시험을 식품의약품안전처로부터 승인받았다고 1일 밝혔다.
이번 임상 1/2a는 건강한 성인을 대상으로 SARS-CoV-2에 대한 mRNA 백신 (EG-COVID)의 안전성 및 면역원성 평가를 목적으로 한다.
회사 측에 따르면 임상은 총 두 단계로 진행될 예정이며 Step 1은 총 45명의 대상자를 3개군으로 나눠 mRNA 용량 기준으로 50㎍, 100㎍, 200㎍을 각각 투여한 뒤, 안전성과 면역원성을 평가한다. Step 2는 Step 1의 1차 결과를 근거로 적정한 2개 용량 투약군을 설정한 뒤, 총 125명을 대상으로 진행된다. 임상시험의 Step 1은 서울아산병원 감염내과에서 수행되며 Step 2는 다기관 임상으로 진행될 예정이다.
아이진 관계자는 “식약처에서 단기간 많은 자료를 검토해 품질시험법과 임상시험 프로토콜 가 이드를 제시하고 생산시설의 실태조사 역시 빠르게 진행하는 등 임상에 진입할 수 있도록 적극적인 도움을 줬다”라며 “이러한 큰 노력의 결과로 국내 자체 기술로 개발된 mRNA 기반의 코로나 백신 임상을 드디어 개시할 수 있게 된 점을 기쁘게 생각한다”고 말했다.
이어 “올해 하반기 중에는 일차적인 중간결과를 확인할 수 있을 것으로 기대하고 있으며 이를 기반으로 최대한 빠르게 연내 후속 임상 진입을 목표로 삼고 있다”고 밝혔다.
아이진 관계자는 “일반적으로 mRNA는 체내에 투입 후 8시간에서 16시간 정도에 degradation(생체 내 자연 분해 후 감소)되고 24시간 후부터는 거의 존재하지 않게 되는데, EG-COVID의 mRNA는 24시간 후부터 빠르게 감소하면서 48시간까지 천천히 degradation이 되기 때문에, 당사 고유의 전달체 system인 양이 온성 리포솜이 mRNA를 잘 보호하면서 효과적으로 delivery하는 것으로 예측된다”고 설명했다.
이어 “이러한 특징이 기존 mRNA 백신에 비해서 안전성은 뛰어나면서도 면역원성에서도 충분한 효과를 얻을 수 있을 것으로 기대할 수 있는 근거가 된다”고 덧붙였다.
한편 아이진은 상반기에 추진한 유상증자의 성공을 통해 임상 및 후속 연구에 필요한 일부 자금을 확보했으며, 확보된 자금의 상당 부분을 EG-COVID 개발과 생산에 투입할 계획이다. 또한 후속 임상과 상업화를 위한 생산 설비를 한국비엠아이와 함께 구축 중인 것으로 알려져 있다.
[관련기사]
아이진, 코로나19 예방백신 임상 1·2a상 IND 신청
2021-06-30 16:12
아이진, 대상포진 예방백신 호주 임상 1상 종료
2021-06-15 11:32
아이진 대상포진백신, ‘싱그릭스’ 동등 수준 면역원성 확인
2021-04-14 10:11
아이진, mRNA 코로나 백신 비임상 논문 ‘BioRxiv’ 게재
2021-03-24 11:50
아이진, 양이온성 리포좀 포함 면역증강조성물-용도 미국 특허등록
2020-11-24 14:46
전체댓글 0개
등록된 댓글이 없습니다.
오늘의 헤드라인
-
01 국내 CNS 치료제 분야 1위 명인제약,유가증... -
02 생명연 "디지털바이오·AI 융합 '간암 비침습... -
03 위고비, 비만치료제 최초 대사 이상 관련 지... -
04 신일제약, 상반기 매출 388억…영업이익 37% ... -
05 셀리드, 감염병 대응 전임상시험 지원사업 선정 -
06 진스크립트, 새로운 글로벌 정체성 '가능성... -
07 네이처셀, '희비' 교차 '조인트스템' 국내... -
08 에이프로젠, 호주 식약청서 면역항암제 중저... -
09 유방암 치료, 상급종합병원 90% 1등급…간암... -
10 미국 관세 부과, 인도-중국 관계 개선...의...











