뉴스
파미셀, 간경변 줄기세포치료제 임상 3상 승인
셀그램-LC 200명 환자 대상 임상 계획…2심 재판 별개로 진행
박선혜 기자 │ loveloveslee@yakup.com


입력 2020-12-03 09:42
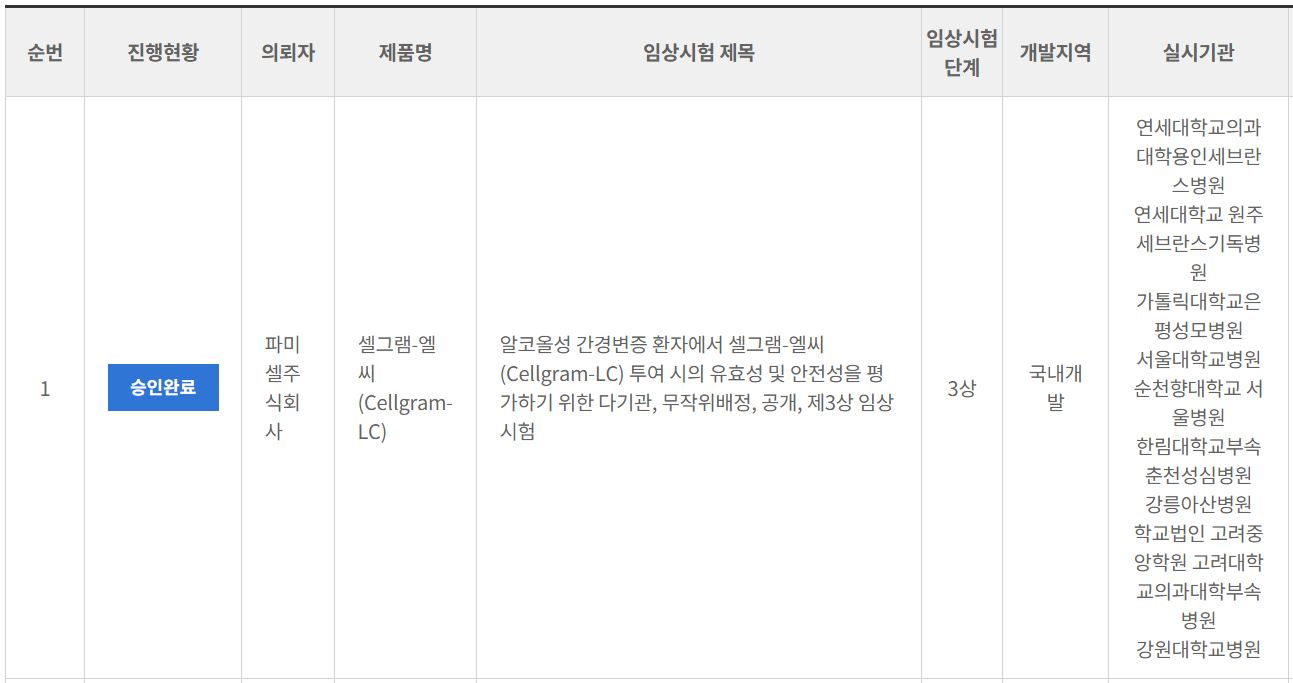
줄기세포치료제 전문업체인 파미셀은 식품의약품안전처로부터 간경변 줄기세포치료제 `셀그램-LC`의 상업화 임상 3상시험 승인을 받았다고 3일 밝혔다.
셀그램-LC는 알코올로 손상된 간 조직의 섬유화를 개선하고 간 기능 회복에 효과를 높이는 줄기세포 치료 주사제다.
|
이번 3상 임상은 총 200명의 알코올성 간경변증 환자를 대상으로 이뤄질 예정이다. 자가 골수유래 중간엽 줄기세포를 투여하는 `시험군`과 최선의 지지요법만 시행하는 `대조군`으로 각 100명씩 무작위 배정해 치료 효과와 안전성을 평가하게 된다.
파미셀은 앞서 임상 2상 성공후 셀그램-LC에 대한 조건부 허가를 식약처에 신청했지만 지난해 2월 반려 처분을 받았다. 이후 파미셀은 식약처를 상대로 행정소송을 제기해 올해 7월 승소한 바 있다. 이후 식약처가 서울고등법원에 항소하면서 현재 2심 재판을 진행중이다.
파미셀은 앞서 임상 2상 성공후 셀그램-LC에 대한 조건부 허가를 식약처에 신청했지만 지난해 2월 반려 처분을 받았다. 이후 파미셀은 식약처를 상대로 행정소송을 제기해 올해 7월 승소한 바 있다. 이후 식약처가 서울고등법원에 항소하면서 현재 2심 재판을 진행중이다.
전체댓글 0개
등록된 댓글이 없습니다.
오늘의 헤드라인
-
01 차바이오텍,'CordSTEM-ST' 조기난소부전 임... -
02 클립스비엔씨, MRSA 감염증 예방 백신후보... -
03 이엔셀, 첨단바이오의약품 제조 공급 계약 ... -
04 온코크로스, ASCO서 'AI 대사체 기반 조기 ... -
05 베이진, ‘비원메디슨’으로 상호 변경...글... -
06 코어라인소프트, MS 이어 베링거인겔하임 ... -
07 GC녹십자, 헌터라제 임상3상서 운동능력 개... -
08 인트론바이오, 혁신 ‘로봇 박테리오파지’ 플... -
09 램시마SC, 유럽 전체 점유율 22%.. 4년 만에... -
10 LG화학,성장호르몬제 치료반응 예측 AI 개발...











